Krebs Zyklus
Der Krebszyklus , der vom Anglizismus auch als Zitronensäurezyklus bezeichnet wird, ist ein Stoffwechselweg, der in allen aeroben Organismen vorhanden ist und dessen Hauptfunktion darin besteht, die Gruppen Acetyl , insbesondere aus dem Abbau von Kohlenhydraten , Fetten und Proteinen , zu oxidieren , um Energie zurückzugewinnen die Form von acht Elektronen mit hohem Potential und Transfer eines Moleküls von GTP oder ATP ; Elektronen mit hohem Übertragungspotential, gewonnen aus NADH und Ubichinol (CoQ 10 H 2) oder Coenzym Q 10 reduziert ), kann dann durch die Atmungskette zirkulieren , um wiederum die Bildung zusätzlicher ATP-Moleküle durch oxidative Phosphorylierung zu ermöglichen .
Dieser Zyklus wurde in den 1930er Jahren schrittweise entdeckt , wobei einige seiner Elemente vom ungarischen Molekularbiologen Albert Szent-Györgyi identifiziert wurden, während der deutsche Biochemiker Hans Adolf Krebs 1937 seine zyklische Funktion hervorhob . Er entfaltet sich im Zytoplasma von Prokaryoten und in den Mitochondrien der Eukaryoten . Es ist ein Zyklus, da der letzte Metabolit , Oxalacetat , ebenfalls an der ersten Reaktion beteiligt ist. Der erste Schritt besteht darin, die Acetylgruppe von Acetyl-CoA auf Oxalacetat zu übertragen, um Citrat zu bilden , das dem Ring seinen Namen in englischer und germanischer Sprache gab. Die folgenden Schritte bilden eine Folge von Reaktionen, die jeweils durch ein bestimmtes Enzym katalysiert werden und zur allmählichen Oxidation der Acetylgruppe in zwei Moleküle Kohlendioxid (CO 2) führen). Dabei produziert dieser Zyklus auch Vorläufer für die Biosynthese bestimmter proteinogener Aminosäuren , während NADH in einer Vielzahl von biochemischen Reaktionen eingesetzt werden kann .
Der Krebszyklus ist der gemeinsame Endpunkt des Abbaus von Polyholosiden ( Glykolyse , Pentosephosphatweg ), Lipiden ( β-Oxidation ) und Aminosäuren , die zur Bildung von Acetyl-CoA führen. Letzteres ist eine Form des Transports von Acetylgruppen aus Pyruvat . Es gibt auch Fluchtreaktionen im Zyklus, die verschiedene Biosynthesen ermöglichen; Der Glyoxylatzyklus , der bei Tieren fehlt , aber insbesondere bei Pflanzen vorhanden ist , ist unter anderem ein Beispiel für solche Stoffwechselwege unter Verwendung des Krebszyklus.
Die Tatsache, dass der Krebszyklus für viele anabole und katabolische Stoffwechselwege essentiell ist , legt nahe, dass er wahrscheinlich eines der ersten Grundelemente des Zellstoffwechsels war, das während der Evolution stattfand , möglicherweise durch Abiogenese . Es hängt mit Reaktionen zusammen, die in anaeroben Bakterien auftreten, und soll sich in mehreren Stadien entwickelt haben. Es gibt theoretisch mehrere Alternativen zum Krebszyklus, aber letzterer scheint am effizientesten zu sein: Wenn sich mehrere Alternativen unabhängig voneinander entwickelt haben, müssen sie alle zum Krebszyklus konvergiert haben.
Stadien des Krebszyklus
Die folgende Tabelle fasst die zehn Stadien des Krebszyklus zusammen, die durch acht verschiedene Enzyme katalysiert werden . Diese Schritte sind je nach Art bemerkenswert konserviert , aber die Enzyme können sich andererseits von Organismus zu Organismus erheblich unterscheiden. Die in dieser Tabelle gezeigten Reaktionen und Enzyme sind diejenigen, die bei Säugetieren vorherrschen .
| Substrate | Produkte | Enzym | Art der Reaktion | Bemerkungen | |
|---|---|---|---|---|---|
| 1 |
Oxalacetat + Acetyl-CoA + H 2 O. |
Citrat + CoA-SH |
Citrat-Synthase ( EC ) |
Crotonisierung | Irreversible, erstreckt Oxalacetat (4C) in einem Molekül mit sechs Atome von Kohlenstoff |
| 2 | Zitrat |
cis- Conitit + H 2 O. |
Aconitase ( EC ) |
Dehydration | Reversible Isomerisierung |
| 3 |
cis- Conitit + H 2 O. |
Isocitrat | Flüssigkeitszufuhr | ||
| 4 |
Isocitrat + NAD + |
Oxalosuccinat + NADH + H + |
Isocitratdehydrogenase ( EC ) |
Oxidation | Produkt von NADH (entspricht 2,5 ATP ) |
| 5 | Oxalosuccinat |
α-Ketoglutarat + CO 2 |
Decarboxylierung | Grenzreaktion, irreversibler Schritt, Herstellung eines Moleküls mit fünf Kohlenstoffatomen. |
|
| 6 |
α-Ketoglutarat + NAD + + CoA-SH |
Succinyl-CoA + NADH + H + + CO 2 |
Α-Ketoglutarat-Dehydrogenase-Komplex ( EC ) |
Oxidative Decarboxylierung |
Irreversibler Schritt, der NADH (entspricht 2,5 ATP ) erzeugt und zu einem Molekül mit vier Kohlenstoffatomen führt (ohne Coenzym A ) |
| 7 |
Succinyl-CoA + BIP + P i |
Succinat + CoA-SH + GTP |
Succinyl-CoA-Synthetase ( EC ) |
Phosphorylierung | oder ADP → ATP anstelle von GDP → GTP erzeugt ein ATP- Molekül oder ein Äquivalent Die Kondensationsreaktion von GDP mit dem P i und die Hydrolyse von Succinyl-CoA beinhaltet das Molekül H 2 O. erforderlich für das Gleichgewicht der Reaktion. |
| 8 |
Succinat + CoQ 10 |
Fumarat + CoQ 10 H 2 (Ubichinol) |
Succinatdehydrogenase ( EC ) |
Oxidation | Verwendet FAD als prothetische Gruppe (FAD → FADH 2in der ersten Reaktionsstufe), entsprechend 1,5 ATP |
| 9 |
Fumarat + H 2 O. |
L- Malate |
Fumarase ( EC ) |
Flüssigkeitszufuhr | |
| 10 |
L- Malate + NAD + |
Oxalacetat + NADH + H + |
Malatdehydrogenase ( EC ) |
Oxidation | Reversibel (in Wirklichkeit fördert das Gleichgewicht die Bildung von L- Malat ), Produkt von NADH (entspricht 2,5 ATP ) |
Synthese von Citrat
Die Citrat-Synthase kondensiert das Oxalacetat und das Acetyl-CoA in Citrat unter Freisetzung von CoA . Ein vorübergehendes Zwischenprodukt, Citroyl-CoA, wird gebildet . Die Thioesterbindung von Acetyl-CoA ist eine Bindung mit hohem Hydrolysepotential . Die Kopplung der Hydrolase- und Synthase-Aktivitäten ermöglicht die Synthesereaktion thermodynamisch . Diese Reaktion ist ein regulatorischer Schritt des Zyklus, wobei Succinyl-CoA , NADH , Acetyl-CoA , Citrat und ATP die Reaktionsgeschwindigkeit negativ beeinflussen .
|
|
+ Acetyl-CoA + H 2 O. → CoA + |

|
| Oxalacetat | Zitrat | |
| Citrat-Synthase - EC | ||
Citrat-Dehydration
Die Aconitase , eine Lyase , katalysiert die Dehydratisierung von Citrat in cis- Aconitat . Obwohl das Citratmolekül symmetrisch zu sein scheint, wurde gezeigt, dass der Wasseraustritt zwischen den vom Oxalacetat abgeleiteten Kohlenstoffatomen stattfindet :

|
H 2 O. + |
|
| Zitrat | cis- Conitate | |
| Aconitase - EC | ||
Hydratisierung von cis- Aconitat
Die Aconitase katalysiert auch die Hydratisierung von cis- Aconitat in Isocitrat :
|
|
+ H 2 O. |

|
| cis- Conitate | Isocitrat | |
| Aconitase - EC | ||
Die beiden vorherigen Schritte, katalysiert durch Aconitase , führen zur Isomerisierung von Citrat zu Isocitrat :

|
H 2 O. + |
|

|
|
| Zitrat | cis- Conitate | Isocitrat | ||
| Aconitase - EC | ||||
Oxidation von Isocitrat
Die Isocitratdehydrogenase , eine Oxidoreduktase , katalysiert die Oxidation von Isocitrat in Oxalosuccinat :

|
+ NAD + NADH + H + + |
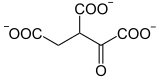
|
| Isocitrat | Oxalosuccinat | |
| Isocitratdehydrogenase - EC | ||
Die eukaryotischen Verwendung eines Isocitratdehydrogenase NAD + -abhängigen ( EC ), die als eine erfordert Cofaktor Ionen Mn 2+ oder Mg 2+ . Die Prokaryoten selbst verwenden eine Isocitrat-Dehydrogenase- NADP + -abhängig ( EC ).
Oxalosuccinat-Decarboxylierung
Die Isocitratdehydrogenase katalysiert auch die Decarboxylierung von Oxalosuccinat , flüchtigem α-Ketoglutarat, unter Entwicklung von CO 2in einer irreversiblen Reaktion:

|
→ CO 2 + |

|
| Oxalosuccinat | α-Ketoglutarat | |
| Isocitratdehydrogenase - EC | ||
Es ist auch ein regulatorischer Schritt im Zyklus mit NADH und ATP als negativen Effektoren . Im Gegenteil, das Vorhandensein von ADP fördert die Aktivität der Isocitratdehydrogenase und damit die Geschwindigkeit dieser Reaktion.
Oxidative Decarboxylierung von α-Ketoglutarat
Der α-Ketoglutarat-Dehydrogenase-Komplex katalysiert die oxidative Decarboxylierung von α-Ketoglutarat zu Succinyl-CoA unter Bildung von NADH + H + und Freisetzung von CO 2. Es ist eine ähnliche Reaktion wie die Umwandlung von Pyruvat in Acetyl-CoA , katalysiert durch den Pyruvat-Dehydrogenase-Komplex . Dieser Enzymkomplex umfasst nacheinander drei Enzyme - α-Ketoglutarat-Dehydrogenase , Dihydrolipoamid-S-Succinyltransferase und Dihydrolipoyl-Dehydrogenase - und fünf Cofaktoren : TPP , Lipoamid , Coenzym A , FAD und NAD + . Diese Reaktion ist irreversibel.

|
+ CoA-SH + NAD + → NADH + H + + CO 2 + |

|
| α-Ketoglutarat | Succinyl-CoA | |
| Α-Ketoglutarat-Dehydrogenase-Komplex - EC | ||
Das NADH , das GTP und das Succinyl-CoA sind negative Effektoren auf die Aktivität des enzymatischen Komplexes.
Succinatbildung
Die Synthetase Succinyl CoA oder Succinat Thiokinase wandelt Succinyl CoA in Succinat und Coenzym A um und bildet ein GTP- Molekül in Tieren oder ATP in Pflanzen und Bakterien . Diese Reaktion ist reversibel.

|
+ BIP / ADP + Pi GTP / ATP + CoA + |
|
| Succinyl-CoA | Succinate | |
| Succinyl-CoA-Synthetase (Bildung von GTP / ATP) - EC / EC | ||
Oxidation von Succinat
Die Succinatdehydrogenase , eine Oxidoreduktase , katalysiert die Oxidation von Succinat zu Fumarat unter gleichzeitiger Reduktion von Ubichinon ( Coenzym Q 10)) in Ubichinol (CoQ 10 H 2). Dieses Enzym flavoprotéique zu ADF ist der Komplex II der Atmungskette . Es wird durch Malonat gehemmt . Da FAD eine prothetische Gruppe ist, die kovalent an das Enzym gebunden ist, überträgt es nur Elektronen und Protonen auf das „echte“ CoQ 10- Substrat..
|
|
+ FAD FADH 2 + |
|
| Succinate | Fumarat | |
| Succinatdehydrogenase - EC | ||
Diese Reaktion ist die vierte und letzte regulatorische Reaktion im Zyklus. Malonat ist hier der kompetitive Inhibitor.
Fumarat-Hydratation
Die Fumarase , eine Lyase, katalysiert die Hydratation von Fumarat zu L- Malat .
|
|
+ H 2 O. |

|
| Fumarat | L- Malate | |
| Fumarase - EC | ||
Oxidation von Malat: Schließen des Kreislaufs
Die Malat - Dehydrogenase , eine Oxidoreduktase , wandelt die L -malat in Oxalacetat unter Bildung von NADH + H + .

|
+ NAD + NADH + H + + |
|
| L- Malate | Oxalacetat | |
| Malatdehydrogenase - EC | ||
Diese Reaktion wird durch eine NAD + -abhängige Malatdehydrogenase ( EC ) in Eukaryoten und eine Chinon- abhängige ( EC ) in Prokaryoten .
Krebszyklus Überprüfung
Der Krebszyklus besteht aus 10 Schritten, die von acht verschiedenen Enzymen katalysiert werden . Während des Zyklus erzeugt wird , von einem Mol von Acetat und bis zu dem CO 2 Stufeund H 2 O. ::
- 2 Mol CO 2
- 3 Mol NADH + H +
- 1 Mol CoQ 10 H 2
- 1 Mol GTP
Es ist ersichtlich, dass der Krebszyklus nur ein ATP- Äquivalent (ein GTP ) produziert, dh weniger als Glykolyse (vier ATP- Moleküle für ein Glucosemolekül , von denen zwei während der "Aktivierungs" -Phase der Glykolyse verwendet werden - Schritte 1 und 3, die Phosphorylierungen entsprechen ). Der größte Teil der potenziellen chemischen Energie wird in Form von Reduktionskraft ( NADH + H + und CoQ 10 H 2) erzeugt). Diese reduzierende Kraft wird anschließend in der Atmungskette der Mitochondrien verwendet , um 11 andere ATP- Moleküle über einen Protonengradienten und eine ATP-Synthase zu produzieren, die manchmal fälschlicherweise dem Krebszyklus zugeschrieben werden.
| Beschreibung | Substrate | Produkte |
| Die Summe aller Oxidationsreaktionen von Acetyl-CoA durch den Krebszyklus (ohne Atmungskette ) entspricht: | Acetyl-CoA + 3 NAD + + CoQ 10 + BIP + P i + 2 H 2 O. | → CoA-SH + 3 (NADH + H + ) + CoQ 10 H 2 + GTP + 2 CO 2 |
| Zurück zur Decarboxylierung von Pyruvat ergeben sich folgende Ergebnisse: | Pyruvat + 4 NAD + + CoQ 10 + BIP + P i + 2 H 2 O. | → 4 (NADH + H + ) + CoQ 10 H 2 + GTP + 3 CO 2 |
| Zurück zur Oxidation von Glucose durch Glykolyse ergeben sich folgende Ergebnisse: | Glucose + 10 NAD + + 2 CoQ 10+ 2 ADP + 2 BIP + 4 P i + 2 H 2 O. | → 10 (NADH + H + ) + 2 CoQ 10 H 2 + 2 ATP + 2 GTP + 6 CO 2 |
Dies entspricht insgesamt der gesamten aeroben Atmung ( Glykolyse , Krebszyklus, Reduktion von NAD + - und CoQ 10 -Coenzymen durch die Atmungskette ) zwischen 30 und 38 ATP für ein geschätztes Glucosemolekül, teilweise abhängig von dem ATP-abhängigen mitochondrialen Shuttle, das zum Transport von NAD + aus der Glykolyse verwendet wird.
Die Verwendung von Glukose durch aerobe Atmung ist energischer als die Fermentation .
In Gegenwart einer großen Menge Acetyl-CoA kann der Krebszyklus überfordert sein, insbesondere bei Diabetikern mit schwerem Insulinmangel oder nach längerem Fasten (siehe diabetische Ketoazidose für weitere Einzelheiten).
Variationen
Obwohl der Krebszyklus zwischen den Arten im Allgemeinen sehr konserviert ist, gibt es signifikante Unterschiede in den Enzymen, die in den verschiedenen Taxa vorhanden sind . Insbesondere gibt es Unterschiede zwischen Prokaryoten und Eukaryoten . Somit ist die Umwandlung von D - threo -isocitrate zu α-Ketoglutarat wird durch eine katalysierte NAD + -abhängigen Isocitrat - Dehydrogenase ( EC ) in Eukaryonten , sondern NADP + -abhängige ( EC ) in Prokaryoten. Dasselbe gilt für die Umwandlung von L -malat zu Oxalacetat , katalysiert durch einen NAD + -abhängigen Malat - Dehydrogenase ( EC ) in Eukaryonten und Chinon -abhängigen ( EC ) in Prokaryoten.
Die Umwandlung von Succinyl-CoA zu Succinat durch Succinyl-CoA-Synthetase zeigt eine signifikante Variabilität. Die meisten Lebewesen verwenden ein ADP- abhängiges Enzym ( EC ), während Säugetiere auch die GDP- abhängige Isoform ( EC ) dieses Enzyms verwenden. Die Verwendungsrate jeder dieser beiden Formen des Enzyms hängt von den betrachteten Geweben ab . Bei bestimmten Bakterien , die Acetat produzieren , wie Acetobacter aceti (en) , ist es ein völlig anderes Enzym, das diese Reaktion katalysiert, in diesem Fall Succinyl-CoA: Acetat-CoA-Transferase ( EC ): Dieses Enzym führt die Verbindung von Essigsäure durch Stoffwechsel mit dem Krebszyklus in diesen Organismen. Einige Bakterien wie Helicobacter pylori verwenden für diese Reaktion ein noch anderes Enzym, in diesem Fall die 3-Oxosäure-CoA-Transferase ( EC ).
Es gibt auch eine gewisse Variabilität im vorherigen Schritt, dh bei der Umwandlung von α-Ketoglutarat zu Succinly-CoA . Die meisten Lebewesen verwenden den α-Ketoglutarat-Dehydrogenase-Komplex , aber einige Bakterien verwenden die α-Ketoglutarat-Synthase ( EC ). Andere Organismen, einschließlich Bakterien und Archaea autotrophen und obligatorische methanotrophen vollständig umgehen den Succinyl-CoA und CONVERT α-Ketoglutarat zu Succinat über die Succinatsemialdehyd durch Einwirkung nacheinander der α-Ketoglutarat - Decarboxylase ( EC ) und Succinat-semialdehyd - Dehydrogenase ( EG ).
Verordnung
Die irreversiblen Stadien des Krebszyklus können reguliert werden: Stadium der Citrat-Synthase , Isocitrat-Dehydrogenase und des α-Ketoglutarat-Dehydrogenase-Komplexes :
- Die Citrat-Synthase wird durch ADP aktiviert, aber durch NADH , ATP und Citrat inhibiert . Es wird daher jeweils durch die Reduktionskraft, die Energieladung und das Reaktionsprodukt, das es katalysiert, gehemmt.
- Die Isocitratdehydrogenase wird durch Calcium und ADP aktiviert und durch NADH und ATP gehemmt .
- Der α-Ketoglutarat-Dehydrogenase-Komplex wird durch Calcium aktiviert und durch NADH , ATP und sein Reaktionsprodukt Succinyl-CoA inhibiert .
Die Regulation des Krebszyklus hängt in erster Linie von der Verfügbarkeit des Substrats und der Hemmung durch die Reaktionsprodukte ab. Wenn diese Reaktionen nicht reguliert würden, würde der Krebszyklus große Mengen an Stoffwechselenergie verschwenden, indem überschüssiges ATP und reduzierte Coenzyme wie NADH produziert würden .
- NADH wird von allen Dehydrogenasen des Zyklus mit Ausnahme der Succinatdehydrogenase produziert und hemmt den Pyruvatdehydrogenasekomplex , die Isocitratdehydrogenase , den α-Ketoglutaratdehydrogenasekomplex sowie die Citrat-Synthase .
- Das Acetyl-CoA hemmt den Pyruvat-Dehydrogenase-Komplex, während das Succinyl-CoA den α-Ketoglutarat-Dehydrogenase-Komplex und die Citrat-Synthase hemmt . In-vitro- Tests an Krebszyklusenzymen zeigen, dass ATP die Citrat-Synthase und den α-Ketoglutarat-Dehydrogenase-Komplex hemmt; Der ATP-Spiegel in vivo variiert jedoch zwischen Ruheperioden und anhaltender Aktivität nicht um mehr als 10%, und kein bekannter allosterischer Mechanismus erlaubt es, die Aktivität eines Enzyms mit einer Variation von höchstens 10% der Konzentration signifikant zu modulieren eines allosterischen Effektors.
- Das Kation von Calcium Ca 2+ wirkt als Regulator. Der Kalziumspiegel in der mitochondrialen Matrix kann einige zehn Mikromol pro Liter erreichen . Es aktiviert die Pyruvatdehydrogenase-Phosphatase , die wiederum die Pyruvatdehydrogenase (E1) -Komponente des Pyruvatdehydrogenasekomplexes aktiviert . Es aktiviert auch die Isocitrat-Dehydrogenase und den α-Ketoglutarat-Dehydrogenase-Komplex. Dies erhöht die Reaktionsgeschwindigkeit mehrerer Stufen des Zyklus und erhöht daher den Fluss der Verbindungen durch diesen Stoffwechselweg .
- Das Citrat wirkt durch Hemmung der Phosphofructokinase , die an der Glykolyse beteiligt ist und somit zur Bildung von Pyruvat über das Fructose-1,6-bisphosphat beiträgt . Dies bildet eine Rückkopplungsschleife zwischen den beiden Stoffwechselwegen.
Die 2007 veröffentlichten Arbeiten zeigten einen wichtigen Zusammenhang zwischen Krebszyklus-Zwischenprodukten und der Regulation von Hypoxie-induzierten Faktoren ( HIF ). Sie spielen eine Rolle bei der Homöostase von Sauerstoff als Transkriptionsfaktoren, die an der Angiogenese , dem Gefäßumbau, der Mobilisierung von Glukose , dem Ionentransport und der Apoptose beteiligt sind . HIF konstitutiv synthetisiert und Hydroxylierung von mindestens einer der zwei Reste von Prolin ist , in ihrer Wechselwirkung mit dem Komplex beteiligte Ubiquitin - Ligase , die als Ziel für einen schnellen Abbau bezeichnet. Diese Reaktion wird durch Prokollagen-Prolin-Dioxygenasen katalysiert . Sowohl Fumarat als auch Succinat sind wirksame Inhibitoren dieser Enzyme, die HIFs stabilisieren können.
Integration mit wichtigen Stoffwechselwegen
Anaplerotische und kataplerotische Routen
Im Krebszyklus laufen mehrere Stoffwechselwege zusammen. Die meisten dieser Reaktionen produzieren Metaboliten, die am Zyklus beteiligt sind, und sind daher anaplerotische Reaktionen . Prozesse, die andererseits Krebszyklusmetaboliten verbrauchen, sollen kataplerotisch sein.
Alle Zwischenprodukte des Krebszyklus - wie Citrat , Isocitrat , α-Ketoglutarat , Succinat , Fumarat , L- Malat und Oxalacetat - werden mit jeder Umdrehung des Zyklus regeneriert. Durch Erhöhen der verfügbaren Menge eines dieser Metaboliten wird die Gesamtmenge aller Metaboliten im Zyklus erhöht, da jedes Zwischenprodukt allmählich in alle anderen Zwischenprodukte im Zyklus umgewandelt wird. Dies ist der Grund, warum die Produktion eines der Metaboliten des Krebszyklus eine allgemeine anaplerotische Wirkung auf diesen Zyklus hat, während der Konsum eines Metaboliten auch eine kataplerotische Wirkung auf den gesamten Zyklus hat.
Pyruvat - Moleküle aus resultierender Glykolyse werden aktiv von dem transportierten Cytosol an die mitochondriale Matrix durch die innere Mitochondrienmembran . In der Matrix können sie oxidiert werden und mit Coenzym A unter Bildung von CO 2 reagieren, Acetyl-CoA und NADH , oder sie können werden carboxyliert durch Pyruvatcarboxylase zu bilden Oxalacetat . Dies ist eine anaplerotische Reaktion, die den Fluss und damit den Fluss durch den Krebszyklus erhöht, wenn die Zelle einem erhöhten Bedarf an metabolischer Energie ausgesetzt ist , beispielsweise in Myozyten .
Zyklusfütterung mit Acetyl-CoA
Das Acetyl-CoA , das aus der Oxidation von Pyruvat oder der β-Oxidation von Fettsäuren stammt , wird jedoch niemals durch den Krebszyklus regeneriert: Im Gegenteil, jede Umdrehung des Zyklus verbraucht ein Molekül Acetyl-CoA pro Oxalacetatmolekül die mitochondrialen Matrix, während der Acetyl - Rest von Acetyl-CoA ist vollständig oxidiert CO 2und in H 2 O.durch die Atmungskette , wodurch die metabolische Energie in Form von ATP durch oxidative Phosphorylierung zurückgewonnen werden kann .
Die Stoffwechselwege, die Acetyl-CoA produzieren oder verbrauchen, sind daher für den Krebszyklus nicht anaplerotisch oder kataplerotisch.
Glukogenese
In der Leber ist die Carboxylierung von cytosolischem Pyruvat zu mitochondrialem Oxalacetat ein fortgeschrittener Schritt in der Gluconeogenese , bei der Laktat und desaminiertes Alanin unter der Wirkung eines erhöhten Glucagon- und / oder Adrenalinspiegels im Blut in Glucose umgewandelt werden . Unter diesen Bedingungen zeigt die Bildung von Oxalacetat in den Mitochondrien keinen anaplerotischen Effekt, da mitochondriales L- Malat zur Bildung von cytosolischem Oxalacetat verbraucht wird, das in Glucose umgewandelt wird.
Proteinabbau
Bei dem Verfahren des Abbaus von Proteinen , die Polypeptidketten werden gespalten durch Peptidasen in den Aminosäuren , die sie darstellen. Ihre Kohlenstoffkette kann dann:
- den Krebs - Zyklus geben - wie zum Beispiel im Fall von Glutamat und Glutamin , die in Form von eingeben α-Ketoglutarat - das stellt eine anaplerotische Wirkung - wir sprechen von Aminosäuren glucoforming , weil sie ausgerichtet werden können gluconeogenesis über die L -Malat ;
- in Acetyl-CoA umgewandelt werden , um oxidiert zu werden und Energie zu erzeugen, wie dies bei Leucin , Isoleucin , Lysin , Phenylalanin , Tryptophan und Tyrosin der Fall ist ;
- in Ketonkörper umgewandelt werden , die entweder durch andere Gewebe als die Leber, in denen sie produziert werden, oxidiert oder über den Urin oder durch Atmung ausgeschieden werden können - diese werden als ketoformende Aminosäuren bezeichnet .
Lipidabbau
Bei dem Verfahren der Lipolyse , Triglyceride wird hydrolysiert in Glycerin und Fettsäuren . In der Leber kann das Glycerin im Rahmen der Gluconeogenese über das Phosphatdihydroxyaceton und das Glycerinaldehyd-3-phosphat in Glucose umgewandelt werden . In vielen Geweben , einschließlich der Herz- und Skelettmuskulatur , werden Fettsäuren durch β-Oxidation abgebaut , wodurch mitochondriales Acetyl-CoA entsteht, das in der Lage ist, sich dem Krebszyklus anzuschließen. Fettsäuren mit einer ungeraden Anzahl an Atomen von Kohlenstoff produziert Propionyl-CoA , die in umgewandelt wird Succinyl-CoA und schließt sich den Krebs - Zyklus wie Zwischen anaplerotischen.
Metaboliten als Substrate für die Biosynthese
Mehrere Metaboliten des Krebszyklus sind an der Biosynthese wichtiger Verbindungen beteiligt und zeigen einen signifikanten kataplerotischen Effekt auf den Zyklus.
Produktion von Kohlenhydraten und Lipiden
Da Acetyl-CoA die Mitochondrien nicht so lassen kann, wie es ist , wird das Citrat durch die innere Mitochondrienmembran von der Mitochondrienmatrix zum Cytosol transportiert , wo es durch ATP-Citrat-Lyase in Acetyl-CoA und Oxalacetat gespalten wird . Oxalacetat kann zur Glukoneogenese in der Leber verwendet oder in L- Malat umgewandelt werden und sich den Mitochondrien anschließen. Cytosolisches Acetyl-CoA wird zur Biosynthese von Fettsäuren und Cholesterin verwendet . Letzteres kann wiederum zur Herstellung von Steroidhormonen , Gallensäuren und Vitamin D verwendet werden .
Während Gluconeogenese , mitochondriale Oxalacetat wird reduziert zu Malat , die anschließend aus den Mitochondrien transportiert wird , werden oxidiert , wieder zu Oxalacetat im Cytosol . Letztere wird dann decarboxyliert zu Phosphoenolpyruvat durch Phosphoenolpyruvatcarboxykinase , der das ist kinetisch bestimmende Schritt in der Umwandlung in Glukose praktisch alle der glucoforming Vorläufern - wie die glucoforming Aminosäuren und Lactat - durch die Leber und den Nieren .
Produktion von Aminosäuren
Die Kohlenstoffkette vieler nicht essentieller Aminosäuren stammt aus Metaboliten des Krebszyklus. Das Aspartat und Asparagin stammen aus dem Oxalacetat , während Glutamin , das Prolin und das Arginin aus dem α-Ketoglutarat stammen . Die Amingruppe stammt von Glutamat durch Transaminierung an einem α-Ketosäure unter Verwendung von Enzymen unter Verwendung von Pyridoxalphosphat als Cofaktor ; Während dieser Reaktionen wird Glutamat in α-Ketoglutarat umgewandelt, das ein Metabolit des Krebszyklus ist.
Produktion von Nukleinsäurebasen
Das Aspartat und das Glutamin sind auch an der Biosynthese von Nucleobasen Purin beteiligt , die in die Zusammensetzung der Nucleinsäure - DNA und RNA - eingehen, sowie von Nucleotiden wie ATP , dem cyclischen AMP , dem NAD , dem ADF und CoA . Pyrimidin- Nucleinsäurebasen sind ihrerseits von Aspartat abgeleitet, das selbst von Oxalacetat abgeleitet ist .
Produktion von Porphyrinen
Die meisten Kohlenstoffatome in Porphyrinen stammen von Succinyl-CoA , einem Metaboliten des Krebszyklus. Porphyrine sind die prothetischen Gruppen von Hämoproteinen wie Hämoglobin , Myoglobin und Cytochromen .
Anmerkungen und Referenzen
- (in) " Der Nobelpreis für Physiologie oder Medizin 1937: Albert Szent-Györgyi " , 1937(abgerufen am 7. November 2015 ) : " Der Nobelpreis für Physiologie oder Medizin 1937 wurde an Albert Szent-Györgyi verliehen" für seine Entdeckungen im Zusammenhang mit den biologischen Verbrennungsprozessen unter besonderer Berücksichtigung von Vitamin C und der Katalyse von Fumarsäure . " .
- (in) " Der Nobelpreis für Physiologie oder Medizin 1953: Hans Krebs, Fritz Lipmann " (abgerufen am 7. November 2015 ) : " Der Nobelpreis für Physiologie oder Medizin 1953 wurde gleichermaßen an Hans Adolf Krebs vergeben" Für seine Entdeckung der Zitronensäure Säurezyklus "und Fritz Albert Lipmann" für seine Entdeckung des Coenzyms A und seiner Bedeutung für den Zwischenstoffwechsel ". " .
- (in) H. Gest , " Evolutionäre Wurzeln des Zitronensäurezyklus in Prokaryoten " , Biochemical Society Symposium , vol. 54, 1987, p. 3-16 ( PMID 3332996 )
- (in) Enrique Meléndez-Hevia, Thomas G. Waddell und Marta Cascante , " Das Rätsel des Krebs-Zitronensäure-Zyklus: Zusammenstellung der chemisch realisierbaren Reaktionen und Opportunismus bei der Gestaltung von Stoffwechselwegen während der Evolution " , Journal of Molecular Evolution , vol. 43, n o 1, September 1996, p. 293-303 ( PMID 8703096 , DOI 10.1007 / BF02338838 , online lesen )
- (in) Oliver Ebenhöh und Reinhart Heinrich , " Evolutionäre Optimierung von Stoffwechselwegen. Theoretische Rekonstruktion der Stöchiometrie von ATP- und NADH-produzierenden Systemen “ , Bulletin of Mathematical Biology , vol. 63, n o 1, Januar 2001, p. 21-55 ( PMID 11146883 , DOI 10.1006 / bulm.2000.0197 , online lesen )
- (in) Takehiko SAHARA, Yasuhiro Takada, Yoji Takeuchi Naoto YAMAOKA und Noriyuki FUKUNAGA , " Klonierung, Sequenzierung und Expression eines Gens, das die monomere Isocitratdehydrogenase des stickstofffixierenden Bakteriums codiert, Azotobacter vinelandii " , Bioscience, Bioscience und Biochemistry , vol. 66, n o 3, März 2002, p. 489-500 ( PMID 12005040 , DOI 10.1271 / bbb.66.489 , online lesen )
- (en) Michel E. van der Rest, Christian Frank und Douwe Molenaar , „ Funktionen der membranassoziierten und cytoplasmatischen Malatdehydrogenasen im Zitronensäurezyklus von Escherichia coli “ , Journal of Bacteriology , vol. 182, n o 24, Dezember 2000, p. 6892-6899 ( PMID 11092847 , PMCID 94812 , DOI 10.1128 / JB.182.24.6892-6899.2000 , online lesen )
- (in) RK Porter und MD Brand , " Leitfähigkeit Mitochondriale Protonen- und H + / O-Verhältnisse sind unabhängig von der Elektronentransportrate in isolierten Hepatozyten " , Biochemical Journal , vol. 310, 1995, p. 379–382 ( online lesen )
- (in) David O. Lambeth, Kristin N. Tews, Steven Adkins, Dean Fröhlich und Barry I. Milavetz , " Expression von zwei Succinyl-CoA-Synthetasen mit unterschiedlichen Spezifitäten Nucleotid in Säugetiergeweben " , Journal of Biological Chemistry , vol. 279, n o 35, 27. August 2004, p. 36621-36624 ( PMID 15234968 , DOI 10.1074 / jbc.M406884200 , online lesen )
- (in) Elwood A. Mullins, Julie A. Francois und Joseph T. Kappock , " Ein spezialisierter Zitronensäurezyklus, der Succinyl-Coenzym A (CoA) erfordert: Acetat-CoA-Transferase (AARC) verleiht dem Acidophilus Acetobacter aceti Resistenz gegen Essigsäure " , Journal of Bacteriology , vol. 190, n o 14, Juli 2008, p. 4933-4940 ( PMID 18502856 , PMCID 2447011 , DOI 10.1128 / JB.00405-08 , online lesen )
- (in) Irene E. Corthésy-Theulaz Gabriela E. Bergonzelli, Henry Hughes, Daniel Bachmann, Daniel F. Schorderet, Andre L. Blum und Nicholas L. Ornston , " Klonierung und Charakterisierung von Helicobacter pylori succinyl CoA: Acetoacetat-CoA-Transferase, ein Roman Prokaryotisches Mitglied der CoA-Transferase-Familie “ , Journal of Biological Chemistry , vol. 272, n o 41, 10. Oktober 1997, p. 25659-25667 ( PMID 9325289 , DOI 10.1074 / jbc.272.41.25659 , online lesen )
- (in) Anthony D. Baughn, Scott J. Garforth, Vilchèze Catherine und William R. Jacobs Jr. , " Eine α-Ketoglutarat-Ferredoxinoxidoreduktase vom anaeroben Typ vervollständigt den oxidativen Tricarbonsäurezyklus von Mycobacterium tuberculosis " , PLoS Pathogens , vol. 5, n o 11, November 2009, e1000662 ( PMID 19936047 , PMCID 2773412 , DOI 10.1371 / journal.ppat.1000662 , online lesen )
- (in) Shuyi Zhang und Donald A. Bryant , " Der Tricarbonsäurezyklus in Cyanobakterien " , Science , vol. 334, n o 6062, 16. Dezember 2011, p. 1551-1553 ( PMID 22174252 , DOI 10.1126 / science.1210858 , online lesen )
- (in) Maxim V. Ivannikov und Gregory T. Macleod , " Mitochondriale freie Ca2 + -Niveaus und ihre Auswirkungen auf den Energiestoffwechsel in motorischen Nervenenden von Drosophila " , Biophysical Journal , Vol. 104, n o 11, 4. Juni 2013, p. 2353-2361 ( PMID 23746507 , PMCID 3672877 , DOI 10.1016 / j.bpj.2013.03.064 , online lesen )
- (in) Richard Denton, Philip J. Randle, Barbara J. Bridges, Ronald H. Cooper, Alan L. Kerbey, Helen T. Pask, David L. Severson, David und Susan Whitehouse Stansbie , " Regulation der Pyruvatdehydrogenase von Säugetieren " , Molecular and Cellular Biochemistry , vol. 9, n o 1, Oktober 1975, p. 27-53 ( PMID 171557 , DOI 10.1007 / BF01731731 , online lesen )
- (en) Hemmung von Hypoxie-induzierbaren Faktor (HIF) -Hydroxylasen durch Zwischenprodukte des Zitronensäurezyklus. MÖGLICHE VERBINDUNGEN ZWISCHEN ZELLMETABOLISMUS UND STABILISIERUNG VON HIF , " Peppi Koivunen, Maija Hirsilä, Anne M. Remes, Ilmo E. Hassinen, Kari I. Kivirikko und Johanna Myllyharju " , Journal of Biological Chemistry , vol. 282, n O 7, 16. Februar 2007, p. 4524-4532 ( PMID 17182618 , DOI 10.1074 / jbc.M610415200 , online lesen )
- (in) Premjit P. Halarnkar und Gary J. Blomquist , " Vergleichende Aspekte des Propionatstoffwechsels " , Vergleichende Biochemie und Physiologie Teil B: Vergleichende Biochemie , vol. 92, n o 2 1989, p. 227-231 ( PMID 2647392 , DOI 10.1016 / 0305-0491 (89) 90270-8 , online lesen )
Siehe auch
Zum Thema passende Artikel
- Atmungskette : Die Zukunft von NADH, H +
- Zellatmung
- Glykolyse
- Die Hauptwege des Stoffwechsels (auf Wikibooks)
- Hans Adolf Krebs
- Calvin-Zyklus , Chloroplasten : biochemische Reaktionen der Photosynthese
