Asparagin
| Asparagin | |
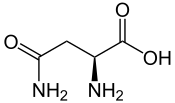 L oder S (-) - Asparagin D oder R (+) - Asparagin 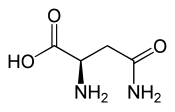 |
|
| Identifizierung | |
|---|---|
| IUPAC-Name | 2,4-Diamino-4-oxobutansäure |
| Synonyme |
N, Asn, (2 S ) -2-Amino-3-carbamoylpropansäure |
| N o CAS |
(racemisch) (D) oderR(+) (L) oderS(-) |
| N o ECHA | 100.019.565 |
| N o EG | 200-735-9 (L) |
| LÄCHELN |
NC (= O) CC (N) C (= O) O , |
| InChI |
InChI: InChI = 1 / C4H8N2O3 / c5-2 (4 (8) 9) 1-3 (6) 7 / h2H, 1,5H2, (H2,6,7) (H, 8,9) |
| Chemische Eigenschaften | |
| Brute Formel |
C 4 H 8 N 2 O 3 [Isomere] |
| Molmasse | 132,1179 ± 0,0051 g / mol C 36,36%, H 6,1%, N 21,2%, O 36,33%, |
| pKa | l-Asparagin: p K a 1 = 2,16 , p K a 2 = 8,73 bei 25 ° C. |
| Physikalische Eigenschaften | |
| T ° Fusion | 235 ° C. |
| Löslichkeit | 25,1 g · kg -1 |
| Volumenmasse | 1 g · cm & supmin; ³ |
| Biochemische Eigenschaften | |
| Codons | AAU, AAC |
| isoelektrischer pH | 5.41 |
| Essentielle Aminosäure | Nein |
| Vorkommen bei Wirbeltieren | 4,4% |
| Vorsichtsmaßnahmen | |
| WHMIS | |
|
Unkontrolliertes ProduktDieses Produkt wird nicht gemäß den WHMIS-Klassifizierungskriterien kontrolliert. |
|
| Einheiten von SI und STP, sofern nicht anders angegeben. | |
Das Asparagin (Abkürzungen IUPAC - IUBMB : Asn und N ) ist eine saure α-Aminosäure , deren Enantiomer L ist eine der 22 proteinogenen Aminosäuren , kodiert auf der mRNA durch Codon AAU und AAC. Sein Van-der-Waals-Radius beträgt 96 Å . Es resultiert aus der Amidifizierung des terminalen Carboxyls von Aspartat . Es gibt polare Reste, die elektrisch neutral und neigen dazu , zu bilden Wasserstoffbrückenbindungen durch seine Amid - Gruppe .
Biosynthese und Abbau
Der Vorläufer von Asparagin ist Oxalacetat. Oxalacetat wird unter Verwendung eines Transaminaseenzyms in Aspartat umgewandelt. Das Enzym überträgt die Aminogruppe von Glutamat auf Oxalacetat und produziert α-Ketoglutarat und Aspartat. Das Enzym Asparaginsynthetase produziert Asparagin, AMP, Glutamat und Pyrophosphat aus Aspartat, Glutamin und ATP. Bei der Asparaginsynthetase-Reaktion wird ATP verwendet, um Aspartat zu aktivieren und β-Aspartyl-AMP zu bilden. Glutamin ergibt eine Ammoniumgruppe, die mit β-Aspartyl-AMP unter Bildung von Asparagin und freiem AMP reagiert.
Strukturelle Funktionen
Oligosaccharide werden während der N-Glykosylierung an Asparagin gebunden .
Das Radikal dieser Aminosäure ist darüber hinaus maßgeblich für die Selektivität von Aquaporin verantwortlich . In der Tat verhindert es durch die Herstellung schwacher Bindungen mit Wasser im Aquaporin die Bewegung von H + -Protonen entlang von Wassermolekülen.
Anekdoten
- Asparagin war die erste Aminosäure, die 1806 von Louis-Nicolas Vauquelin entdeckt wurde, der dann Spargel studierte , daher der Name.
- Asparagin wird häufig mit dem charakteristischen Geruch von Urin nach Einnahme von Spargel in Verbindung gebracht, aber einige Wissenschaftler sind anderer Meinung und implizieren andere Substanzen wie Spargelsäure .
Anmerkungen und Referenzen
- "Eigenschaften von Aminosäuren" in CRC Handbook of Chemistry and Physics , 91 th Edition (Internet Version 2011), WM Haynes, Hrsg., CRC Press / Taylor und Francis, Boca Raton, FL., P. 7-1
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- (in) Herr Beals, L. Gross, S. Harrell, " Aminosäurefrequenz " am Institut für Umweltmodellierung (ITSH) an der Universität von Tennessee (abgerufen am 26. Juli 2015 )
- " Asparagin (l-) " in der Datenbank der Chemikalien Reptox der CSST (Quebec Organisation, die für Sicherheit und Gesundheitsschutz am Arbeitsplatz zuständig ist), abgerufen am 25. April 2009
- (in) SC Mitchell , " Food Idiosyncrasies: Rote Beete und Spargel " , Drug Metabolism and Disposition , Vol. 29, n o 4,1 st April 2001, p. 539-543 ( ISSN 0090-9556 und 1521-009X , PMID 11259347 , online gelesen , abgerufen am 20. Januar 2017 )
- (in) ML Pelchat , C. Bykowski , FF Duke und Dr. Reed , " Ausscheidung und Wahrnehmung eines charakteristischen Geruchs bei der Einnahme von Spargel nach dem Urin: eine psychophysische und genetische Studie " , Chemical Senses , Vol. 36, n o 1,1 st Januar 2011, p. 9–17 ( ISSN 0379-864X , PMID 20876394 , PMCID PMC3002398 , DOI 10.1093 / chemse / bjq081 , online gelesen , abgerufen am 20. Januar 2017 )