Milchsäure
| Milchsäure | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
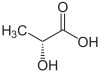
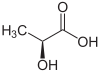
| R- Enantiomer von Milchsäure (oben, links), S-Milchsäure (oben, rechts) und dreidimensionale Struktur von S-Milchsäure (unten). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifizierung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-Name | 2-Hydroxypropansäure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS |
(RS) (S+ oder L) (R- oder D) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.017 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EG | 200-018-0 209-954-4 ( RS ) 201-196-2 ( S ) 233-713-2 ( R ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code | G01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E270 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2611 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LÄCHELN |
CC (O) C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = InChI = 1 / C3H6O3 / c1-2 (4) 3 (5) 6 / h2,4H, 1H3, (H, 5,6) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | farblose bis gelbe viskose Flüssigkeit oder farblose bis gelbe Kristalle (DL) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formel |
C 3 H 6 O 3 [Isomere] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molmasse | 90,0779 ± 0,0037 g / mol C 40%, H 6,71%, O 53,29 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 3,86 ( 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° Fusion |
T / L : 16,8 ° C L : 53 ° C T : 53 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° Kochen | 122 ° C ( 12 mmHg ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Löslichkeit | leicht geschliffen. im Äther ; Einlegesohle in Chloroform , Petrolether , Schwefelkohlenstoff |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mischbarkeit | mischbar mit Wasser , Alkohol , Glycerin und Furfuraldehyd , ein Sol. Alkohol-Äther | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumenmasse | 1,248 5 g cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammpunkt | 110 ° C (geschlossene Tasse) (DL) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brechungsindex | 1.4414 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Drehkraft |
-2,6 ° ( 80 g l -1 , R) + 2,6 ° ( 25 g l -1 , S) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vorsichtsmaßnahmen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Milchsäure: Produkt nicht eingestuftDie Einstufung dieses Produkts wurde noch nicht von der Toxicological Directory Service Disclosure mit 1,0% gemäß der Inhaltsstoffoffenlegungsliste validiert Milchsäure, (dl-): E,  E : Stark saures korrosives Material (berechneter pH = 1,9 für eine 9 %ige Lösung) Angabe bei 1,0 % gemäß der Inhaltsstoffliste |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Richtlinie 67/548 / EWG | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Xi Symbole : Xi : Reizend R-Sätze : R38 : Reizt die Haut. R41 : Gefahr ernster Augenschäden. S-Sätze : S26 : Bei Berührung mit den Augen sofort gründlich mit Wasser abspülen und Arzt konsultieren. S39 : Augen-/Gesichtsschutz tragen. R-Sätze : 38, 41, S-Sätze : 26, 39, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verwandte Verbindungen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isomere (s) | 3-Hydroxypropansäure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Einheiten von SI und STP, sofern nicht anders angegeben. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die Milchsäure ist eine organische Säure , die in verschiedenen biochemischen Prozessen eine Rolle spielt . Das Laktat ist die konjugierte Base dieser Säure (d. h. die ionisierte Form der Milchsäure). Im Gegensatz zu dem, was der Name vermuten lässt, ist Milchsäure nicht nur in der Milch enthalten, aus der sie zuerst vom schwedischen Chemiker Carl Wilhelm Scheele gewonnen wurde . Es kommt auch in Wein , bestimmten Obst- und Gemüsesorten , in tierischen Zellen vor, wo es dissoziiert und in Form von Laktat vorliegt, sowie in bestimmten Zubereitungen ( Sauerkraut usw.).
Milchsäure ist eine α-Hydroxysäure , ihre Rohformel ist C 3 H 6 O 3 und seine Struktur spiegelt sich in seinem systematischen Namen 2-Hydroxypropansäure wider.
Chemie
Das Atom von Kohlenstoff 2 der Lagergruppe Hydroxy ist asymmetrisch macht das Molekül von Milchsäure chiral . Es liegt daher in Form von zwei Enantiomeren vor :
- ( R )-Milchsäure oder D(-)-Milchsäure;
- ( S )-Milchsäure oder L(+)-Milchsäure.
In Lösung kann die Carboxylgruppe -COOH ein H + -Ion verlieren . Somit Milchsäure (C 3 H 6 O 3 ) in transformierte Lactat - Ion : CH 3 CHOHCOO -.
Andererseits werden im Muskel zwei H + -Ionen zu Pyruvat (C 3 H 3 O 3 ) hinzugefügt, um Lactat (C 3 H 5 O 3 2+ ) zu bilden .
Milchsäure ist wasserlöslich und gilt als schwache Säure ( pKa = 3,90), d.h. die Dissoziationsreaktion in Wasser ist nicht abgeschlossen:
CH 3 CHOHCOOH+ H 2 O⇄ CH 3 CHOHCOO -+ H 3 O +Milchsäure kommt daher sowohl in Lösung als auch in ihrer basischen Form, dem Laktat-Ion, in unterschiedlichen Anteilen je nach pH-Wert vor .
Muskelanstrengung und Milchsäuregärung
Milchsäure ist vor allem in der Muskulatur eines der Schlüsselprodukte bei der Energiegewinnung. Die Zellatmung (Verbrauch von Zucker zur Energiegewinnung) kann in zwei Hauptstadien unterteilt werden, die erste ist die Glykolyse , der zytoplasmatische Teil des Prozesses, der in Abwesenheit von Sauerstoff abläuft. Es liefert Pyruvat, das den zweiten, mitochondrialen Teil der Zellatmung ( Krebs-Zyklus und oxidative Phosphorylierung) liefert, was zur Reduzierung des Sauerstoffs im Wasser führt. An einem Ende der Kette wird Glucose oxidiert und am anderen Sauerstoff reduziert. Die freigesetzte Energie wird von der Zelle zurückgewonnen.
Ist die Sauerstoffzufuhr größer als der Zuckerverbrauch, wird die gesamte produzierte Brenztraubensäure sofort im mitochondrialen Teil verbraucht.
Wenn der Zuckerverbrauch die Sauerstoffzufuhr übersteigt (intensive Anstrengungen), wird ein Teil der im ersten Teil des Prozesses produzierten Brenztraubensäure zu Milchsäure reduziert, wodurch der oxidative Kreislauf der Glykolyse fortgesetzt werden kann. Es ist eine Gärung . Der mitochondriale Teil wird gesättigt und die Energieausbeute stark reduziert. Diese Theorie des Zuckerverbrauchs / Sauerstoffverbrauchs wird jedoch in Frage gestellt. Was die anaerobe Energieausbeute betrifft, so scheint sie im Gegensatz zu den allgemein akzeptierten Angaben proportional höher als die aerobe Energieausbeute zu sein.
Laktat passiert die Zellmembran und gelangt in den Blutkreislauf. Die Leber , Skelettmuskulatur, Herz und Gehirn kann dieses Substrat für Energie. Die Leber recycelt es in der sogenannten Glukoneogenese, die Glukose neu synthetisiert, während ein anderer Teil vom Myokard sowie von den durch sportliche Anstrengung weniger beanspruchten Muskeln oxidiert wird. Laktat wird ca. eine Stunde nach dem Training ohne sportliche Aktivität nach dem Sport, dh lange vor dem Einsetzen der Muskelsteifheit , für die es daher nicht verantwortlich ist, metabolisiert .
Bakterielle Fermentation
Es gibt zwei Hauptarten der bakteriellen Fermentation, die Milchsäure produzieren: in Wein und Milchprodukten.
- Im Wein ist dies die malolaktische Gärung : Apfelsäure, die von Natur aus im Wein enthalten ist, wird unter der Einwirkung von Bakterien in Milchsäure zerlegt.
- In Milch und Milchprodukten entsteht Milchsäure durch den Abbau von Laktose durch Bakterien. Je frischer die Milch, desto weniger Milchsäure enthält sie. Die Milchsäurekonzentration in Milch wird in Dornic Grad (°D) angegeben: 1 °D entspricht 0,1 g Milchsäure pro Liter Milch. Eine frische Milch enthält 15 bis 18 ° D , Wachteln 60 - 70 ° D .
Die für das Auftreten von Milchsäure verantwortlichen Organismen sind Laktobazillen . Wenn sie im Mund operieren, kann die produzierte Milchsäure zu Karies führen .
Dieser Milchsäuregärungsmodus tritt auch bei bestimmten Gemüsesorten auf ( Kohl = Sauerkraut , und andere sogenannte „laktofermentierte“ Gemüse). Milchsäure als verwendete AHA in der Kosmetik wird nicht aus Milch gewonnen , sondern zum Beispiel Zucker aus Rüben , Heidelbeeren , usw.
Verwendet
Quelle.
Direkt in menschlicher Nahrung
Milchsäure wird in der Lebensmittelindustrie als Zusatzstoff (E270) als Antioxidans , Säuerungsmittel oder Geschmacksverstärker verwendet . Milchsäure ist auch in Form von Salzen vorhanden: Natrium- ( E325 ), Kalium- ( E326 ) und Calciumsalz ( E327 ). Diese Salze liegen in Pulverform vor und sind auch in Wasser löslich. Es wirkt bakteriostatisch insbesondere auf pathogene Bakterien wie Salmonellen (oder Listerien ) und auch dämpfend auf die Wasseraktivität .
Nach Untersuchungen in Quebec scheint Milchsäure eines der natürlichsten Mittel zur Vorbeugung von Blasenkrebs , aber auch von Hautkrebs zu sein .
In der Kosmetik
Diese Säure wird manchmal als Teil eines ästhetischen Peelings verwendet, insbesondere bei gefärbter Haut (Reihen von Produkten zur ästhetischen Verfärbung bestehen aus Milchsäure); diese Säure muss jedoch unter Aufsicht eines Dermatologen und unter Dosierungsbedingungen und spezifischer Verdünnung entsprechend dem Hauttyp des Patienten angewendet werden.
Als Dekontaminations- und Reinigungsmittel
Milchsäure gewann in der Waschmittelindustrie nach den 2000er Jahren an Bedeutung und ist ein guter Entkalker , Seifenentferner und antibakterielles Mittel. Es ist auch wirtschaftlich vorteilhaft und Teil eines Trends zu sichereren und natürlicheren Inhaltsstoffen für die Umwelt. In den Vereinigten Staaten wird daher Milchsäure zur bakteriellen Dekontamination von Rinderschlachtkörpern in Schlachthöfen verwendet . Das Rindfleisch unterlag dieser Praxis zunächst von der Europäischen Union verboten , da die Verwendung von Milchsäure hier dazu dient, einen Mangel an Hygiene im Zusammenhang mit laxen Holzeinschlagspraktiken zu korrigieren. Im Rahmen des Kompromisses zur Einfuhr von nordamerikanischem Rindfleisch nach Europa nach dem Embargo für Hormon-Rindfleisch wurde diese Verwendung nach der Veröffentlichung der europäischen Verordnung 101/2013 von vornherein endgültig zugelassen.Februar 2013. In Europa ist diese Praxis grundsätzlich nachvollziehbar.
Kunststoffvorstufe
Milchsäure wird zu Polymilchsäure (PLA) polymerisiert , einem biologisch abbaubaren Kunststoff, der insbesondere für 3D-Drucker , für Lebensmittelverpackungen und in der Chirurgie verwendet wird .
Historisch
Milchsäure wurde von Carl Wilhelm Scheele (1742-1786) entdeckt.
Handel
Frankreich ist im Jahr 2014 laut französischem Zoll Nettoimporteur von Milchsäure. Der durchschnittliche Importpreis pro Tonne betrug 1.400 €.
Hinweise und Referenzen
- LACTIC ACID, Sicherheitsblatt (e) des International Program on Chemical Safety , eingesehen am 9. Mai 2009
- „ CAS-Registrierungsnummer: 50-21-5 “ , unter ntp.niehs.nih.gov (Zugriff am 14. Februar 2010 )
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- (en) JG Speight und Norbert Adolph Lange, Lange's Handbook of Chemistry , New York, McGraw-Hill ,2005, 16 th ed. , 1623 S. ( ISBN 978-0-07-143220-7 , LCCN 84643191 ) , p. 2.289
- (in) Carl L. Yaws, Handbook of Thermodynamic Diagrams , Vol. 2, No. 1, Huston, Texas, Golf-Pub. Co.,1996( ISBN 978-0-88415-857-8 , LCCN 96036328 )
- (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman und Susan Budavari, The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals , USA, Merck,2001, 13 th ed. , 2564 S. ( ISBN 978-0-911910-13-1 )
- „ Milchsäure “ in der Datenbank für chemische Produkte Reptox des CSST (Quebec-Organisation für Arbeitssicherheit und Gesundheitsschutz), abgerufen am 24. April 2009
- " Milchsäure, (dl-) " in der Datenbank für chemische Produkte Reptox des CSST (Quebec-Organisation für Arbeitssicherheit und Gesundheitsschutz), abgerufen am 25. April 2009
- " Milchsäure " , auf societechimiquedefrance.fr (Zugriff am 18. September 2019 )
- (in) George A. Brooks , „ Die Wissenschaft und Übersetzung der Laktat-Shuttle-Theorie “ , Zellmetabolismus , Vol. 2 , No. 27, n o 4,April 2018, s. 757–785 ( ISSN 1550-4131 , DOI 10.1016 / j.cmet.2018.03.008 , online gelesen , abgerufen am 30.05.2018 )
- Luc Léger , Georges Cazorla , Cyril Petibois und Laurent Bosquet , „ Laktat und Bewegung: Mythen und Realitäten “, Staps , vol. No. 54, n o 1,2001, s. 63–76 ( ISSN 0247-106X , DOI 10.3917 / sta.054.0063 , online gelesen , abgerufen am 30.05.2018 )
- Pascal Prevost, „ Courbatures “ , über Sciensport ,2006(Zugriff am 8. Januar 2008 )
- UN Wiesmann , S. DiDonato und NN Herschkowitz , „ Wirkung von Chloroquin auf kultivierte Fibroblasten: Freisetzung von lysosomalen Hydrolasen und Hemmung ihrer Aufnahme “, Biochemical and Biophysical Research Communications , vol. 66, n o 4,27. Oktober 1975, s. 1338-1343 ( ISSN 1090-2104 , PMID 4 , online lesen , zugegriffen 1 st April 2018 )
- C. Chêne (2002), Organische Säuren [PDF] , Technological Resource Center for Agro-Food Enterprises, http://www.adrianor.com .
- http://sante.canoe.com/channel_health_news_details.asp?channel_id=2001&relation_id=3483&news_channel_id=2001&news_id=3695
- Fragen und Antworten im Senat
- „ Indikator für den Import/Export-Handel “ , auf der Generalzolldirektion. Geben Sie NC8 = 29181100 an (Zugriff am 7. August 2015 )
Siehe auch
Zum Thema passende Artikel
- Lebensmittelzusatzstoff
- Aroma
- Milch und Wein
- Polymilchsäure , biologisch abbaubares Polymer
Externe Links
- [Video] "Molekularer Mojito - Molekularer Cocktail - Molekulare Küche - Molekulare Gastronomie" auf YouTube ,15. November 2016.
Literaturverzeichnis
- Ackerman SH und Sachar EJ (1974), Die Lactattheorie der Angst: eine Überprüfung und Neubewertung , Psychosom. Med. , Januar-Februar 1974, 36 (1), 69-81.





