Kohlenmonoxid
Ein Kohlenmonoxid ist eine chemische Verbindung , bestehend aus einer Kombination von Atomen von Kohlenstoff und Sauerstoff nur.
Die einfachsten und häufigsten Kohlenoxide sind Kohlenmonoxid CO und Kohlendioxid CO 2. Viele andere stabile, metastabile oder hypothetische Kohlenoxide sind bekannt, werden jedoch selten angetroffen, wie beispielsweise das Kohlenstoffsuboxid C 3 O 2oder Mellitsäureanhydrid C 12 O 9oder sogar sehr selten, wie Tricarbonmonoxid C 3 O.oder das abklingende Kohlenstofftetroxid CO 4.
|
|
|
|

|
|

|
| CO Kohlenstoff - Monoxid |
CO 2 Carbon dioxide |
C 3 O 2 Kohlenstoff suboxide |
C 12 O 9 Mellitsäure anhydrid |
C 3 O. tricarbon monoxid |
CO 4 Kohlenstoff Tetroxyd |
Obwohl in Chemielehrbüchern oft nur die ersten drei und selten die vierten gezeigt werden, ist heute eine große Anzahl anderer Kohlenoxide bekannt, von denen die meisten seit den 1960er Jahren synthetisiert wurden . Einige dieser neuen Oxide sind bei Raumtemperatur stabil. Einige hingegen sind nur bei sehr niedrigen Temperaturen metastabil oder stabil und zersetzen sich beim Erhitzen in einfache Kohlenoxide. Viele sind von Natur aus instabil und können nur vorübergehend als Zwischenprodukte bei chemischen Reaktionen beobachtet werden oder sind so reaktiv, dass sie nur innerhalb einer Gasphase oder unter Bedingungen der Matrixisolierung existieren können.
Der Bestand an Kohlenoxiden scheint stetig zuzunehmen. Die Existenz von Graphenoxid und anderen stabilen polymeren Kohlenoxiden mit grenzenlosen Molekülstrukturen legt nahe, dass noch viele weitere entdeckt werden müssen.
Überblick
Das Kohlendioxid CO 2ist in der Natur sehr verbreitet, wo es insbesondere durch die Atmung von Lebewesen sowie durch die Verbrennung von kohlenstoffhaltigen Substanzen erzeugt wird. Es ist ein wesentliches Stadium in Form von Kohlenstoff während des Kohlenstoffkreislaufs auf der Erde und das Stadium, in dem er von Pflanzen aufgenommen wird. Es wurde nach und nach als eine anerkannte chemische Verbindung , die früher Sylvester spiritus ( „wilden Geist“) oder „feste Luft“ durch verschiedene Chemiker XVII - ten und XVIII - ten Jahrhundert, und nach wie vor häufig Kohlendioxid .
Das Kohlenmonoxid CO kann auch während der Verbrennung entstehen und wurde von der Antike bis zum Schmelzen des Eisens seiner Mineralien verwendet (was nicht erkannt wurde) . Wie Kohlendioxid wurde es in Europa seit dem Mittelalter von verschiedenen Alchemisten und Chemikern beschrieben und untersucht . Seine chemische Zusammensetzung wurde durch entdeckt William Cruikshank in 1800 .
Das Kohlenstoffsuboxid C 3 O 2Wurde durch entdeckt Benjamin Collins Brodie in 1873 durch Hindurchleiten elektrischen Stromes durch Kohlendioxid.
Das vierte "klassische" Kohlenmonoxid, Mellitsäureanhydrid , C 12 O 9Wurde offenbar erhalten Justus von Liebig und Friedrich Wöhler in 1830 während ihres Studiums Mellitgelb (Honigstein), wurde aber erst aus 1913 von Hans Meyer und Karl Steiner.
Brodie entdeckte 1859 auch eine sechste Verbindung namens Graphitoxid , die aus Kohlenstoff und Sauerstoff in Verhältnissen von 2: 1 bis 3: 1 bestand. Die Art und Molekülstruktur dieser Substanz war jedoch bis vor kurzem unbekannt. 2000er Jahre, als sie in Graphenoxid umbenannt wurde und wurde ein Gegenstand der Forschung in der Nanotechnologie .
Bemerkenswerte Beispiele von instabilen oder metastabilen Oxide , die nur in extremen Situationen erkannt werden , sind die dicarbon monoxide Radikal : C = C = O, Kohlenstofftrioxid CO 3, Kohlenstoff - tetroxide CO 4und 1,2-Dioxetandion C 2 O 4. Einige dieser reaktiven Kohlenoxide wurden in den Molekülwolken des interstellaren Mediums durch Rotationsspektroskopie nachgewiesen .
Viele hypothetische Kohlenoxide wurden mit theoretischen Methoden untersucht, aber noch nicht nachgewiesen. Beispiele sind Oxalsäureanhydrid C 2 O 3oder O = (Cyclo-C 2 O.) = O, Ethendion C 2 O 2oder O = C = C = O, andere Polyketone , lineare oder cyclische Polymere von Kohlenmonoxid, (-CO-) nund solche von Kohlendioxid (-CO 2 -) n wie das Dimer 1,3-Dioxetandion C 2 O 4und die 1,3,5-trioxanetrione C 3 O 6 Trimer.
|
|

|

|
|
|
| C 2 O 3 Oxal- anhydrid |
C 2 O 4 1,2-dioxetane- dion |
C 2 O 4 1,3-dioxetane- dion |
C 3 O 6 Trioxan-1,3,5- trion |
C 2 O 2 Ethendion |
Allgemeine Struktur
Üblicherweise werden Kohlenstoff ist vierwertigen , während Sauerstoff ist divalente, und in den meisten Kohlenstoffoxide wie in den meisten Kohlenstoffverbindungen, dann das Kohlenstoffatom kann gebunden an vier andere Atome, während das Atom Sauerstoff kann nur an zwei Atome gebunden sein. Während Kohlenstoff beliebig lange Ketten oder Netzwerke bilden kann, werden Ketten von drei oder mehr aufeinanderfolgenden Oxygenaten selten, wenn überhaupt, beobachtet. Und die elektrisch neutralen Kohlenoxide bekannt bestehen aus einem oder mehreren Kohlenstoffgerüsten, einschließlich Strukturen, zyklische und aromatische , verbunden und eingeschlossen durch Gruppen Oxo , -O- oder = O, und Peroxo , -OO-.
Nicht vierwertige, aber zweiwertige Kohlenstoffatome finden sich in einigen Oxiden wie Biradiralen , Kohlenmonoxid, CO oder: C = O, Dicarbonmonoxid , C 2 O.oder: C = C = O und Tricarbonmonoxid , C 3 O.oder: C = C = C = O, aber abgesehen von dem ersten sind diese Oxide im Allgemeinen zu reaktiv, um in der Menge getrennt zu werden. Der Verlust oder Gewinn von Elektronen erzeugen kann negativ geladen und einwertiger Sauerstoff, -O - , positiv geladene und dreiwertigen Sauerstoff, ≡O +, oder negativ geladen und dreiwertigen Kohlenstoffatomen, ≡C - . Diese beiden letzten Formen finden sich in Kohlenmonoxid, - C≡O +, während negativ geladene Sauerstoffatome in anionischen Oxokohlenwasserstoffen (en) vorkommen .
Lineares Kohlendioxid
Eine der Familien von Kohlenoxiden hat die allgemeine Formel C n O 2oder O = (C =) n O, d. h. es ist eine lineare Kette von sp 2 -Kohlenstoffatomenan jedem Ende durch ein Sauerstoffatom abgedeckt. Die ersten Verbindungen sind:
- CO 2oder O = C = O, Kohlendioxid ;
- C 2 O 2oder O = C = C = O, das extrem instabile Ethendion ;
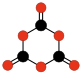
- C 3 O 2oder O = C = C = C = O, metastabiles Kohlenstoffsuboxid oder Tricarbondioxid;
- C 4 O 2oder O = C = C = C = C = O, Tetracarbondioxid oder Butatrien-1,4-dion;
- C 5 O 2oder O = C = C = C = C = C = O, die pentacarbone dioxid , stabil in Lösung bei Raumtemperatur und rein auf -90 ° C .
Mitglieder dieser Familie wurden in Niederdruckgasphasen- oder Kryo- Matrix-Experimenten in Spuren nachgewiesen , insbesondere für n = 7 und für n = 17, n = 19 und n = 21.
Lineare Kohlenmonoxide
Lineare Kohlenmonoxide, C n O.bilden eine weitere Familie von Kohlenoxiden. Sein erstes Mitglied, Kohlenmonoxid, CO, scheint das einzige zu sein, das in seinem reinen Zustand und bei Raumtemperatur stabil ist. Die Photolyse von Kohlendioxid in einer kryogenen Matrix induziert den Verlust einer CO-Einheit, was zu nachweisbaren Mengen Monoxid mit n Paar als C 2 O führtC 4 O.und C 6 O.. Verbindungen bis zu n = 9 wurden auch durch elektrische Entladungen auf in Argon verdünntem Kohlenstoffsuboxid erhalten . Die ersten drei Verbindungen dieser Familie wurden im interstellaren Medium nachgewiesen .
Wenn n gerade ist, Molekül angenommen in einem sein cumulene- wie Triplett - Zustand , wobei alle mit verbundenen Atomen Doppelbindungen und ein leeres Orbital auf dem ersten Kohlenstoff als in: C = C = O ,: C = C = C = C = O und im Allgemeinen: (C =) 2 m = O. Wenn n ungerade ist, wird geschätzt, dass die Triplett- (Radikal-) Struktur mit einem Singulettzustand vom Acetylen- Typ in Resonanz ist , polar mit einer negativen Ladung am terminalen Kohlenstoff und einer positiven Ladung am Sauerstoff am anderen Ende wie in - C≡ CC ≡O + , - C≡CC≡CC≡O + und im Allgemeinen - (C≡C-) 2m C≡O + . Kohlenmonoxid folgt diesem Trend: Seine vorherrschende Form wird als - C≡O + angesehen .
Cyclische Polyketone vom Radialentyp
Eine andere Familie von Kohlenoxiden, die besondere Aufmerksamkeit verdient, ist die von cyclischen Kohlenoxiden vom Radialentyp der allgemeinen Formel C n O noder (CO) n. Sie können als angesehen werden cyclische Oligomere von Kohlenmonoxid oder als n-Tupel - Ketone der n-Kohlenstoffcycloalkanen . Kohlenmonoxid kann als erste Verbindung dieser Familie angesehen werden (n = 1). Theoretische Studien zeigen, dass Ethendion , C 2 O 2oder O = C = C = O und Cyclopropantrion , C 3 O 3kann nicht existieren. Die folgenden drei Verbindungen, C 4 O 4, C 5 O 5und C 6 O 6 sind theoretisch möglich, aber wahrscheinlich nicht sehr stabil und wurden bisher nur in winzigen Mengen synthetisiert.

|

|

|

|
| (CO) 3 Cyclopropan trion |
(CO) 4 cyclobutane- tetron |
(CO) 5 Cyclopentan- Pentone |
(CO) 6 Cyclohexan- hexone |
Auf der anderen Seite ist die Anionen sind diese Kohlenoxide relativ stabil und einige von ihnen sind seit der bekannt XIX - ten Jahrhundert:
| Chemische Formel | IUPAC-Nomenklatur | Apotheke) | Jahr der Entdeckung |
|---|---|---|---|
| C 2 O 22– | Ethindiolat | Bücher & Weiss | 1963 |
| C 3 O 32– | deltieren | Eggerding & West | 1976 |
| C 4 O 42– | quadrieren | Cohen et al. | 1959 |
| C 5 O 52– | Krokodat | Gmelin | 1825 |
| C 6 O 62– | Rhodizonat | Heller | 1837 |
Cyclisches Oxid C 6 O 6bildet auch die stabilen Anionen von Tetrahydroxybenzochinon (C 6 O 64– ) und Hexahydroxybenzol (C 6 O 66– ). Die Aromatizität dieser Anionen wurde mit theoretischen Methoden untersucht.
Neue Kohlenoxide
Seit den 1960er Jahren wurden viele neue stabile oder metastabile Kohlenoxide synthetisiert, wie z. B. (in chronologischer Reihenfolge):
| Formel | IUPAC-Nomenklatur | Kommentar | Entdeckung | Strukturformel (Bild) |
|
|---|---|---|---|---|---|
| Chemiker | Jahr | ||||
| C 10 O 8 | 1,4-Benzochinontetracarbonsäuredianhydrid | Hammond | 1963 |

|
|
| C 6 O 6 | Ethylentetracarbonsäuredianhydrid | stabiles Isomer von Cyclohexanehexon . | Sauer & al. | 1967 |

|
| C 12 O 12 oder C 6(C 2 O 4) 3 |
Hexahydroxybenzoltrisoxalat | permanente Form des Solvats von Tetrahydrofuran . | Verter & Dominic | 1967 |

|
| C 10 O 10 oder C 6 O 2(C 2 O 4) 2 |
1,4-Tetrahydroxybenzochinonbisoxalat | stabil wie Tetrahydrofuransolvat. | Verter & al. | 1968 |

|
| C 8 O 8 oder C 6 O 2(CO 3) 2 |
1,4-Tetrahydroxybenzochinonbiscarbonat | zersetzt , um 45- 53 ° C . | Nallaiah | 1984 |

|
| C 9 O 9 oder C 6(CO 3) 3 |
Hexahydroxybenzoltriscarbonat | zersetzt , um 45- 53 ° C . | Nallaiah | 1984 |

|
| C 24 O 6 | Tris (3,4-Diethynyl-3-cyclobuten-1,2-dion) | ein cyclisches Trimer der Diradikal 3,4-Diethinyl-3-cyclobuten-1,2-dion ▪ C≡C- (C 4 O 2) -C≡C ▪ | Rubin & al. | 1990 |

|
| C 32 O 8 | Tetrakis (3,4-Diethynyl-3-cyclobuten-1,2-dion) | ein Tetramer des 3,4-Diethynyl-3-cyclobuten-1,2-dion-Radikals | Rubin & al. | 1990 |

|
| C 4 O 6 | Dioxantetraketon oder Dimer von Oxalsäureanhydrid | stabil in Et 2 O.bis -30 ° C , aber zersetzt sich bei 0 ° C . | Strazzolini & al. | 1998 |

|
| C 12 O 6 | Hexaoxotricyclobutabenzol | Hamura & al. | 2006 |

|
|
Viele Verbindungen der Nähe dieser Oxide wurden theoretisch untersucht und einige sollen stabil, wie die sein , Carbonat- und Oxalat - Ester von tetrahydroxy-1,2-Benzochinon und rhodizonic , Krokon , Squarylsäure und deltic Säuren .
Polymere Kohlenoxide
Kohlenstoffsuboxid polymerisiert spontan bei Raumtemperatur zu einem Kohlenstoff-Sauerstoff- Polymer mit einem Atomverhältnis von 3: 2. Es wird angenommen, dass das Polymer eine lineare Kette von Lactonen mit 6 Atomen ist, die mit einem kontinuierlichen Kohlenstoffgerüst verschmolzen sind, das aus alternierenden Einfach- und Doppelbindungen besteht. Physikalische Messungen zeigen, dass die durchschnittliche Anzahl von Einheiten pro Molekül in Abhängigkeit von der Bildungstemperatur etwa 5 bis 6 beträgt.

|

|

|

|
| Oligomere von C 3 O 2 von 3 bis 6 Einheiten. | |||
Durch Komprimieren von Kohlenmonoxid auf 5 GPa in einer Diamantambosszelle wird ein ziemlich ähnliches rötliches Polymer mit einem etwas höheren Sauerstoffgehalt erhalten. Es ist bei Umgebungstemperatur und -druck metastabil. Das CO würde in der Zelle überproportional sein und eine Mischung aus CO 2 erzeugenund C 3 O 2wobei letztere ein Polymer bilden, das dem durch spontane Polymerisation von C 3 O 2 erhaltenen ähnlich ist, oben beschrieben, jedoch mit einer unregelmäßigeren Struktur, die einen Teil des darin enthaltenen CO 2 einfängt.
Ein weiteres Kohlenstoff-Sauerstoff-Polymer mit einem C: O-Verhältnis von 2: 1 oder mehr ist das klassische Graphitoxid und seine einschichtige Version, Graphenoxid .
Anmerkungen und Referenzen
- ( Fr ) Dieser Artikel teilweise oder vollständig aus dem Wikipedia - Artikel in genommen englischen Titeln „ Kohlenstoffoxids “ ( siehe die Liste der Autoren ) .
Anmerkungen
- Früher (und noch heute im medizinischen Bereich und in der journalistischen Sprache) bezog sich der Ausdruck "Kohlenmonoxid" speziell auf CO- Monoxid , CO 2 -Dioxid dann als "Kohlendioxid" qualifiziert.
- vgl. die Artikel der verschiedenen Verbindungen dieser Familie.
Verweise
- (en) M. Nic, J. Jirat, B. Kosata, " IUPAC. Kompendium der chemischen Terminologie - Oxocarbons “ , im IUPAC Gold Book , Blackwell Scientific Publications,2006(abgerufen am 24. Mai 2010 )
- (in) R. West , Oxocarbons , New York, Akademische Presse ,1980235 p. ( ISBN 0-12-744580-3 )
- (en) William S. Hummers Jr. und Richard E. Offeman , " Herstellung von Graphitoxid " , J. Am. Chem. Soc. , Vol. 80, n o 6,März 1958, p. 1339-1339 ( ISSN 0002-7863 , DOI 10.1021 / ja01539a017 )
- (in) Ebbe Almqvist , Geschichte der Industriegase , Dordrecht / London, Springer ,2003472 p. ( ISBN 0-306-47277-5 , online lesen ) , p. 93-108
- (in) LH Reyerson und Kenneth Kobe , " Carbon Suboxide " , Chem. Rev. , Vol. 7, n o 4,Dezember 1930, p. 479–492 ( ISSN 0009–2665 , DOI 10.1021 / cr60028a002 )
- (in) BC Brodie , " Anmerkung zur Synthese von Sumpfgas und Ameisensäure und zur elektrischen Zersetzung von Kohlensäure " , Proc. R. Soc. Lond. , Vol. 21,Januar 1873, p. 245-247 ( ISSN 0370-1662 , DOI 10.1098 / rspl.1872.0052 , online lesen )
- (de) F. Wohler , „ Über die Honigsteinsäure “ , Ann. Phys. Chem. , Vol. 83, n O 7,1826, p. 325–334 ( online lesen )
- (von) Hans Meyer und Karl Steiner , „ Über ein neues Kohlenoxyd C 12 O 9 » , Ber. Dtsch. Chem. Ges. , Vol. 46, n o 1,1826, p. 813-815 ( ISSN 0365-9496 , DOI 10.1002 / cber.191304601105 )
- (de) Bugge , „ Ein neues Kohenoxyd “ , Naturwissenschaftliche Wochenschrift , vol. 13, n o 12,1914, p. 188 ( online lesen )
- (in) William B. DeMore und CW Jacobsen , " Bildung von Kohlentrioxid bei der Photolyse von Ozon in flüssigem Kohlendioxid " , J. Phys. Chem. , Vol. 73, n O 9,September 1969, p. 2935-2938 ( DOI 10.1021 / j100843a026 )
- (en) Laurence Y. Yeung , Mitchio Okumura , Jeffrey T. Paci , George C. Schatz , Jianming Zhang und K. Timothy Minton , " hyperthermale O-Atom-Austauschreaktion O 2"+ CO 2durch ein CO 4Intermediate ” , J. Am. Chem. Soc. , Vol. 131, n o 39,10. September 2009, p. 13940–13942 ( ISSN 0002-7863 , DOI 10.1021 / ja903944k )
- (in) Corey S. Jamieson , Alexander M. Mebel und Ralf I. Kaiser , " Neuartiger Nachweis des C-2v-Isomers von Tetraoxidkohlenstoff (CO 4)) ” , Chem. Phys. Lette. , Vol. 440, n Knochen 1-3,25. Mai 2007, p. 105-109 ( ISSN 0009-2614 , DOI 10.1016 / j.cplett.2007.04.043 )
- (in) Herman F. Cordes , Herbert P. Richter und Carl A. Heller , " Massenspektrometrischer Nachweis für die Existenz von 1,2-Dioxetandion (Kohlendioxid-Dimer). Chemilumineszenz-Zwischenprodukt “ , J. Am. Chem. Soc. , Vol. 91, n o 25,Dezember 1969, p. 7209 ( ISSN 0002-7863 , DOI 10.1021 / ja01053a065 )
- (in) Richard Bos , W. Neil Barnett , Gail A. Dyson , Richard A. Russell , Kieran F. Lim und Simon P. Watson , " Untersuchungen zum Mechanismus der Chemilumineszenzreaktion Peroxyoxalat: Teil 1. Bestätigung von 1 2 -Dioxetandion als Zwischenprodukt mittels 13 C-Kernspinresonanzspektroskopie “ , Anal. Chim. Acta. , Vol. 502, n o 230. Januar 2004, p. 141-147 ( ISSN 0003-2670 , DOI 10.1016 / j.aca.2003.10.014 )
- (in) HM Pickett , EA Cohen , BJ Drouin und JC Pearson , Submillimeter-, Millimeter- und Mikrowellen-Spektrallinienkatalog , JPL ,2. Mai 2003359 p. ( online lesen )
- (en) Haijun Jiao und Hai-Shun Wu : „ Sind neutrale Oxocarbons stabil? » , J. Org. Chem. , Vol. 68, n o 4,23. Januar 2003, p. 1475–1479 ( ISSN 0022-3263 , DOI 10.1021 / jo026243m )
- (en) Errol Lewars und Hai-Shun Wu , „ Polymere und Oligomere von Kohlendioxid: ab initio und semiempirische Berechnungen “ , J. Mol. Struct. THEOCHEM , vol. 363, n o 1,29. März 1996, p. 1-15 ( ISSN 0166-1280 , DOI 10.1016 / 0166-1280 (95) 04420-5 )
- (in) Matthew L. Shirel und Peter Pulay , " Stabilität von neuartigem substituiertem Chloroxo und Trioxan " , J. Am. Chem. Soc. , Vol. 121, n o 37,3. September 1999, p. 8544-8548 ( ISSN 0002-7863 , DOI 10.1021 / ja984451j )
- (en) Günter Maier und Hans Peter Reisenauer , Fortschritte in der Carbenchemie: Carbene in Matrizen: Specrospcopy, Struktur und photochemisches Verhalten , vol. 3, Elsevier Science ,2001332 p. ( ISBN 0-444-50892-9 ) , p. 135
- (de) Werner Kutzelnigg , Einführung in die Theoretische Chemie , Weinheim, Wiley-VCH ,Dezember 2001, 1 st ed. 896 p. ( ISBN 3-527-30609-9 )
- (en) Günther Maier , Hans Peter Reisenauer , Heinz Balli , Willy Brandt und Rudolf Janoschek , " C 4 O 2(1,2,3-Butatrien-1,4-dion), das erste Kohlendioxid mit einer geraden Anzahl von C-Atomen “ , Angew. Chem. Int. Ed. , Vol. 29, n o 8,August 1990, p. 905-908 ( ISSN 1433-7851 , DOI 10.1002 / anie.199009051 )
- (en) Günther Maier , Hans Peter Reisenauer , Ulrich Schäfer und Heinz Balli , " C 5 O 2(1,2,3,4-Pentatetraen-1,5-dion), ein neues Kohlenstoffoxid “ , Angew. Chem. Int. Ed. , Vol. 27, n o 4,April 1998, p. 566-568 ( ISSN 1433-7851 , DOI 10.1002 / anie.198805661 )
- (en) Frank W. Eastwood , Gasphasenpyrolytische Verfahren zur Herstellung von Kohlenstoff-Wasserstoff- und Kohlenstoff-Wasserstoff-Sauerstoff-Verbindungen , CRC Press ,1997309 p. ( ISBN 90-5699-081-0 ) , p. 97
- (de) Roman Reusch , Dissertation: Absorptionsspektroskopie von langen Zellkettenmolekülen und deren Oxid in kryogenen Matrizen , Heidelberg, Universität Heidelberg ,Dezember 2005122 p. ( online lesen ) , p. 95
- (en) Teruhiko Ogata und Yoshio Tatamitani , „ Das einfachste lineare Kohlenstoffkettenwachstum durch Atomkohlenstoffaddition und Ringöffnungsreaktionen “ , J. Phys. Chem. A , vol. 1123, n o 43,4. Oktober 2008, p. 10713-10715 ( ISSN 1089-5639 , DOI 10.1021 / jp806725s )
- (in) Gunther Seitz und Peter Imming , " Oxocarbons and Pseudooxocarbons " , Chem. Rev. , Vol. 92, n o 6,September 1992, p. 1227–1260 ( ISSN 0009–2665 , DOI 10.1021 / cr00014a004 )
- (in) Detlef Schröder , Helmut Schwarz , Suresh Dua , Stephen J. Blanksby und John H. Bowie , " Massenspektrometrische Untersuchungen der Oxokohlenwasserstoffe C n O n(n = 3-6) ” , Int. J. Mass Spectrom. , Vol. 188, Nr . 1-2,17. Mai 1999, p. 17-25 ( ISSN 1387-3806 , DOI 10.1016 / S1387-3806 (98) 14208-2 )
- (en) Richard B. Wyrwas und Caroline Chick Jarrold , " Produktion von C 6 O 6aus der Oligomerisierung von CO an Molybdänanionen “ , J. Am. Chem. Soc. , Vol. 128, n o 42,4. Oktober 2006, p. 13688-13689 ( ISSN 0002-7863 , DOI 10.1021 / ja0643927 )
- (in) Werner Büchner und E. Weiss , " Zur Kenntnis der Rechte" Alkalicarbonyle "Die Kristallstruktur von Kaliumacetylendiolaten, KOC≡COK " , Helv. Chim. Acta , vol. 46, n o 4,1963, p. 1121-1127 ( ISSN 0018-019X , DOI 10.1002 / hlca.19630460404 )
- (in) David Eggerding und Robert West , " Synthese von Dihydroxycyclopropenon (Deltinsäure) " , J. Am. Chem. Soc. , Vol. 97, n o 1,Januar 1975, p. 207-208 ( ISSN 0002-7863 , DOI 10.1021 / ja00834a047 )
- (in) David Eggerding und Robert West , " Synthese und Eigenschaften von Deltinsäure (Dihydroxycyclopropenon) und dem Deltat-Ion " , J. Am. Chem. Soc. , Vol. 98, n o 12,Juni 1976, p. 207-208 ( ISSN 0002-7863 , DOI 10.1021 / ja00428a043 )
- (in) Sidney Cohen , John R. Lacher und Joseph D. Park , " Diketocyclobutandiol " , J. Am. Chem. Soc. , Vol. 81, n o 13,Juli 1959, p. 3480 ( ISSN 0002-7863 , DOI 10.1021 / ja01522a083 )
- (De) Leopold Gmelin , " Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene substanzen " , Ann. Phys. Chem. , Vol. 4,1825, p. 31-62 ( online lesen )
- (De) Johann Florian Heller , " Die Rhodizonsäure, Eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre Chemischen Verhältnisse " , Annalen der Pharmacie , vol. 24, n o 1,1837, p. 1-17 ( ISSN 0365-5490 , DOI 10.1002 / jlac.18370240102 , online lesen )
- (in) Haiyan Chen , Michel Armand , Matthew Courty , Meng Jiang , Clare P. Gray , Franck Dolhem , Jean-Marie Tarascon und Philippe Poizot , " Lithiumsalz von Tetrahydroxybenzochinon: Auf dem Weg zur Entwicklung einer nachhaltigen Li-Ionen-Batterie " , J. Am. Chem. Soc. , Vol. 131, n o 25,28. Mai 2009, p. 8984–8988 ( ISSN 0002-7863 , DOI 10.1021 / ja9024897 )
- (in) Robert West und J. Niu , Non-Benzoloid Aromatics , vol. 1, New York, Akademische Presse ,1969
- (in) Paul von Ragué Schleyer , Katayoun Najafian , Boggavarapu Kiran und Haijun Jiao : " Sind Oxocarbon-Dianionen aromatisch? » , J. Org. Chem. , Vol. 65, n o 25. Januar 2000, p. 426–431 ( ISSN 0022-3263 , DOI 10.1021 / jo991267n )
- (en) PR Hammond , " 1,4-benzochinon Tetracarbonsäuredianhydrid, C 10 O 8: A Strong Acceptor ” , Science , vol. 142, n o 3591,25. Oktober 1963, p. 502 ( ISSN 0036-8075 , DOI 10.1126 / science.142.3591.502 )
- (aus) Jürgen Sauer , Barbara Schröder und Richard Wiemer , „ Eine Studie der Diels-Alder-Reaktion, VI. Kinetischer Schutz des Wahrs C 6 O 6(Dianhydrid der Äthylentetracarbonsäure) ' , Chem. Ber. , Vol. 100, n o 1,Januar 1967, p. 306-314 ( ISSN 0009-2940 , DOI 10.1002 / cber.19671000135 )
- (in) HS Verter und R. Dominic , " Ein neues Kohlenoxid: Synthese der Oxalathexahydroxybenzol-Sortierung " , Tetrahedron , Vol. 23, n o 10,1967, p. 8984–8988 ( ISSN 0040-4020 , DOI 10.1016 / S0040-4020 (01) 97894-9 )
- (in) HS Verter , H. Porter und R. Dominic , " Ein neues Kohlenoxid: Synthese von Tetrahydroxybenzochinonbisoxalat " , Chem. Verbreitet. ,1968, p. 973b-974 ( ISSN 1359-7345 , DOI 10.1039 / C1968000973b )
- (en) C. Nallaiah , " Synthese von Tetrahydroxy-1,4-benzochinonbiscarbonat und Hexahydroxybenzoltriscarbonat - neue organische Kohlenoxide " , Tetrahedron , vol. 40, n o 23,1984, p. 4897-4900 ( ISSN 0040-4020 , DOI 10.1016 / S0040-4020 (01) 91324-9 )
- (en) Yves Rubin , Carolyn B. Knobler und François Diederich , „ Vorläufer der Cyclo [n] kohlenstoffe: aus 3,4-Dialkinyl-3-cyclobuten-1,2-dionen und 3,4-Dialkinyl -3-Cyclobuten-1,2-diole zu Cyclobutenodehydroannulenen und höheren Kohlenstoffoxiden “ , J. Am. Chem. Soc. , Vol. 112, n o 4,Februar 1990, p. 1607-1617 ( ISSN 0002-7863 , DOI 10.1021 / ja00160a047 )
- (en) Paolo Strazzolini , Alberto Gambi , Angelo G. Giumanini und Hrvoj Vancik , " Die Reaktion zwischen Ethandioyl (oxalyl) dihalogeniden und Ag 2 C 2 O 4: ein Weg zu Staudgeers schwer fassbarem Ethandisäure (oxalsäure) anhydrid “ , J. Chem. Soc., Perkin Trans. 1 ,1998, p. 2553-2558 ( ISSN 0300-922X , DOI 10.1039 / a803430c )
- (in) Toshiyuki Hamura , Yousuke Ibusuki , Hidehiro Uekusa Takashi Matsumoto , Jay S. Siegel , Kim K. Baldridge und Keisuke Suzuki , " Dodecamethoxy- und Hexaoxotricyclobutabenzol: Synthese und Charakterisierung " , J. Am. Chem. Soc. , Vol. 128, n o 31,15. Juli 2006, p. 10032-10033 ( ISSN 0002-7863 , DOI 10.1021 / ja064063e )
- (en) Holger Butenschön , " Ein neuer Oxocarbon C 12 O 6über stark belastete Benzin-Zwischenprodukte “ , Angew. Chem. Int. Ed. , Vol. 46, n o 22,Mai 2007, p. 4012-4014 ( ISSN 1433-7851 , DOI 10.1002 / anie.200700926 )
- (in) BD Kybett , GK Johnson , CK Barker und JL Margrave , " Die Hitze der Bildung und Polymerisation von Kohlenstoffsuboxid " , J. Phys. Chem. , Vol. 69, n o 10,Oktober 1965, p. 3603-3606 ( DOI 10.1021 / j100894a060 )
- (in) Allen I. Katz , David Schiferl und Robert L. Mills , " Neue Phasen und chemische Reaktionen in festem Kohlenmonoxid unter Druck " , J. Phys. Chem. , Vol. 88, n o 15,Juli 1984, p. 3176-3179 ( DOI 10.1021 / j150659a007 )
- (in) WJ Evans , J. Lipp , C.-S. Yoo , H. Cynn , JL Herberg , RS Maxwell und MF Nicol , " Druckinduzierte Polymerisation von Kohlenmonoxid: Disproportionierung und Synthese eines energetischen laktonischen Polymers " , Chem. Mater. , Vol. 18, n o 10,22. April 2006, p. 2520-2531 ( ISSN 0897-4756 , DOI 10.1021 / cm0524446 )

