Indole
| Indole | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifizierung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Synonyme |
2,3-Benzopyrrol |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.004.019 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EG | 204-420-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LÄCHELN |
c12c ([nH] cc1) cccc2 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C8H7N / c1-2-4-8-7 (3-1) 5-6-9-8 / h1-6.9H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | solides Weiss | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute Formel |
C 8 H 7 N [Isomere] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molmasse | 117,1479 ± 0,0071 g / mol C 82,02%, H 6,02%, N 11,96%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° Fusion | 52,5 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kochen | 254 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Löslichkeit | 3,56 g · l -1 (Wasser, 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumenmasse |
1,22 g · cm & supmin ; ³ (fest) 5,6 (Gas, Luft = 1) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammpunkt | 110 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sättigender Dampfdruck | 1,6 Pa bei 25 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Augen | Reizend | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Einheiten von SI und STP, sofern nicht anders angegeben. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Das Indol ist eine aromatische heterocyclische organische Verbindung . Der Name Indol leitet sich von Indigo ab , einem blauen Pigment, dessen Molekül zwei kondensierte Indolgruppen enthält. Es kann schematisch so beschrieben werden, dass es nebeneinander aus einem Benzolring und einem Pyrrolring besteht . Die Elektronen , die durch das mitgeführte Atom von Stickstoff in der Darstellung von Lewis partizipiert im aromatischen Verlagerung. Im Gegensatz zu herkömmlichen Aminen ist Indol daher keine Base, da der aromatische Charakter bei einer chemischen Reaktion mit diesem Dublett verloren gehen würde.
Indol ist eine Verbindung, die bei Raumtemperatur fest ist und einen starken Duft hat, sowohl blumig als auch pilzartig und tierisch. Es kommt natürlich in vielen weißen Blüten wie Jasmin und Orangenblüten vor und ist für deren berauschenden Charakter verantwortlich. Wie Skatol (oder Methylindol) hat Indol tierische Geruchstöne, die an Fäkalien erinnern können , aber viel weniger ausgeprägt sind als bei Skatol. Indol kann auch den Geruch von Mottenkugeln hervorrufen. Es ist in der Formel vieler Düfte enthalten, hauptsächlich blumig.
Indol ist natürlich in Kohlenteer enthalten . Die Indolstruktur ist in vielen organischen Verbindungen wie Tryptophan (eine Aminosäure, die sie in Gegenwart von Tryptophanase unter zellulärem Stress freisetzt ) sowie in Tryptophan enthaltenden Proteinen in Alkaloiden und Pigmenten vorhanden .
Indol kann eine aromatische elektrophile Substitution eingehen , hauptsächlich in Position 3. Indolsubstituierte Verbindungen sind die Bausteine von Tryptamin- ähnlichen Alkaloiden wie Serotonin (einem Neurotransmitter ) und Melatonin sowie halluzinogenen Tryptaminen wie Psilocybin , Dimethyltryptamin , 5-MEO-DMT oder das LSD .
Andere Indolalkaloide existieren auf natürliche Weise und werden in der Therapie verwendet, wie Vinblastin oder Catharandin, die Antikrebsmittel sind.
Andere von Indol abgeleitete Verbindungen, die als Auxin (ein Hormon der Pflanzen ), Indomethacin (entzündungshemmend) oder Pindolol (ein Betablocker ) bezeichnet werden können
Etymologie und Geschichte
Das französische Wort Indol leitet sich vom deutschen Wort Indol ab , das der Chemiker Adolf von Baeyer geprägt hat , indem er dem Stamm des Wortes Indigo das Suffix -ol hinzufügt .
Die Chemie des Indols begann sich mit der Untersuchung von Indigo , einem blauen Pigment, zu entwickeln.
Dies wurde in transformierten Isatin und dann in oxindol ( Indol - Oxid ). 1866 gelang es Adolf von Baeyer ( Nobelpreis für Chemie 1905) , Oxindol durch Verwendung von Zinkstaub als Reduktionsmittel zu Indol zu reduzieren. 1869 schlug er eine chemische Formel (siehe Bild links) für diese neue Verbindung vor.
Einige Indol - Derivate wurden als Farbmittel zum Ende des verwendeten XIX - ten Jahrhunderts. Das Interesse an dieser Verbindung nahm in den 1930er Jahren zu , als entdeckt wurde, dass Indol ein Baustein für eine große Anzahl von Alkaloiden sowie Auxinen und Tryptophan ist . Indol bleibt eine sehr untersuchte und verwendete Verbindung.
Synthese und Herstellung von Indol
Die wichtigste industrielle Methode zur Herstellung von Indol ist die Destillation von Kohlenteer , von dem Indol einer der wichtigsten Bestandteile ist. Das Indol ist in der zwischen 220 ° C und 260 ° C erhaltenen Destillatfraktion enthalten .
Indol und seine Derivate können auch durch eine Vielzahl chemischer Reaktionen synthetisiert werden. In diesem Kapitel werden nicht alle Synthesetechniken ausführlich dargestellt, sondern ein historischer Überblick.
Bischler-Möhlau-Synthese
Die in den 1880er Jahren entwickelte Bischler-Möhlau-Methode ist eine der ersten Techniken zur Synthese von Indol. Während die Reaktion α-Brom- acetophenon wird mit einem Überschuss an umgesetztem Anilin in Medium Säure einen 2-Aryl-Indol zu bilden. Es erlaubt jedoch nicht die direkte Herstellung von unsubstituiertem Indol.

Fischer-Synthese
Fischers Indolsynthese ist eine bemerkenswerte Reaktion, die von einem der größten organischen Chemiker, Hermann Emil Fischer (Nobelpreis 1902), entdeckt wurde. Es besteht aus einer Addition von Phenylhydrazin an ein Keton oder einen Aldehyd in einem sauren Medium.
Reisserts Synthese
Die 1897 vorgeschlagene Reissert-Synthese ist eine der ersten, die die Synthese von unsubstituiertem Indol in drei Schritten aus ortho-Nitrotoluol ( 1 ) ermöglicht.
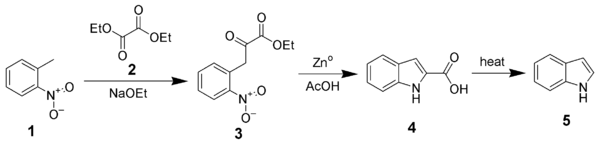
Madelung-Synthese
Die 1912 entwickelte Madelung-Synthese ist eine Reaktion, die die Herstellung von Indol (substituiert oder unsubstituiert) durch intramolekulare Cyclisierung eines N-Phenylamids ermöglicht. Es wird bei hoher Temperatur in Gegenwart einer starken Base durchgeführt .

Leimgruber-Batcho-Synthese
Die 1976 entdeckte und patentierte Leimgruber-Batcho-Indolsynthesemethode ermöglicht die Herstellung von Indol und substituierten Derivaten mit guter Ausbeute. Es wird insbesondere in der pharmazeutischen Industrie zur Herstellung von Arzneimitteln verwendet, deren Struktur Indolderivate enthält.
Diese Synthese wird in zwei Stufen ausgehend von ortho-Nitrotoluol durchgeführt. Dieses wird zuerst in ein Enamin umgewandelt , das dann reduziert wird , um Indol zu erhalten.
Bartoli-Synthese
Die Bartoli-Synthese ist ein Verfahren zur Synthese von substituiertem Indol aus einem ortho-substituierten Nitrobenzol und einem Vinyl- Grignard-Reagenz .

Diese Reaktion funktioniert nur mit einem in ortho-Position substituierten Nitrobenzol (und funktioniert nicht ohne). Drei Organomagnesiumäquivalente werden benötigt, um es erfolgreich abzuschließen.
Verwendung von Indol
Das in der Parfümerie verwendete Jasmin- Absolut enthält etwa 2,5% Indol. Die Herstellung von 1 kg Jasmin-Absolue erfordert mehrere Millionen Blüten und kostet mehrere tausend Euro. Indol wird (zusammen mit vielen anderen Verbindungen) verwendet, um einen Jasminakkord zu viel geringeren Kosten herzustellen.
Indol hat einen starken Duft, der sowohl blumig (Geruch einer weißen Blume) als auch tierisch ist.
Indol wird auch zur industriellen Synthese von Tryptophan durch Fermentation verwendet. Diese Transformation basiert auf der enzymatischen Aktivität der Tryptophansynthase, die von im Fermenter kultivierten Bakterien produziert wird .
Indol ist auch das Ausgangsreagenz für die Synthese einer Vielzahl organischer Verbindungen: Pigmente , Parfümkomponenten , Arzneimittel usw.
Chemische Reaktionen mit Indol
Grundcharakter des Stickstoffdubletts
Obwohl das Atom von Stickstoff ein freies Elektronenpaar (zwei hat Elektronen nicht in beteiligt chemischen Bindungen ), ist viel weniger Indol Grund als Amine oder Anilins . In der Tat ist dieses Elektronendublett delokalisiert und an der Aromatizität des Systems beteiligt. Die Grundform (Indol) ist daher deutlich stabiler als die Säureform (protoniert), bei der die Aromatizität verloren geht. Die protonierte Form hat eine Säurekonstante pK a = -3,6. Es ist daher notwendig, eine starke Säure (wie Salzsäure ) zu verwenden, um eine signifikante Fraktion von Indol zu protonieren.
Aromatische elektrophile Substitution
Aufgrund seines aromatischen Charakters kann Indol eine elektrophile aromatische Substitution eingehen (Substitution eines Wasserstoffatoms durch eine elektrophile Gruppe . Die reaktivste Position in Bezug auf die aromatische elektrophile Substitution ist die C-Position. 3 (die etwa 1000-mal reaktiver ist als diejenigen, die sich am Benzolring befinden ) Beispielsweise wird während einer Vilsmeier-Haack- Formylierung , die bei Raumtemperatur durchgeführt wird, nur die C-3-Position substituiert (siehe Diagramm).

Da die Positionen am Pyrrolring reaktiver sind, können die elektrophilen aromatischen Substitutionen des Benzolrings nur stattfinden, wenn die Positionen N-1, C-2 und C-3 substituiert wurden.
Unter den durch diese Art von Reaktion erhaltenen Verbindungen kann Gramin erwähnt werden , ein wichtiges synthetisches Zwischenprodukt, das durch die Mannich-Reaktion aus Indol, Dimethylamin und Formaldehyd hergestellt wird .

Saurer Charakter eines an Stickstoff gebundenen Wasserstoffatoms
Das von Stickstoff getragene Wasserstoffatom hat einen schwachen sauren Charakter mit einer Säurekonstante pK a = 21 in DMSO . Die Deprotonierung des Stickstoffatoms erfordert daher die Verwendung einer sehr starken Base wie Natriumhydrid oder Butyllithium und eines vollständig wasserfreien Mediums . Die aus der Deprotonierung resultierenden Salze können auf zwei Arten reagieren. Sehr ionische Salze wie Natrium- oder Kaliumsalze reagieren bevorzugt durch einen elektrophilen Angriff auf das Stickstoffatom (linker Kanal im Diagramm). Umgekehrt, je mehr kovalente Salze , insbesondere die organomagnesiums (Grignard Reagenz) und die zink- basierten Komplexen , reagieren bevorzugt über die C-3 - Kohlenstoff (rechte Spur in dem Diagramm). Ebenso beeinflusst das verwendete Lösungsmittel die Reaktion: polare und aprotische Lösungsmittel wie DMF oder DMSO fördern eine Reaktion über das Stickstoffatom, während unpolare Lösungsmittel wie Toluol eine Reaktion über den C-3-Kohlenstoff fördern.

Kohlensäure, Lithiierung von Position 2
In Bezug auf den Säuregehalt ist das sauerste Wasserstoffatom nach dem an das Stickstoffatom gebundenen dasjenige, das an das Kohlenstoffatom in Position 2 gebunden ist. Vorausgesetzt, dass der Schutz des Wasserstoffs zuerst durchgeführt wird. Stickstofffunktion, ist es daher möglich, zu deprotonieren der Kohlenstoff in Position 2, beispielsweise unter Verwendung von Butyllithium oder Lithiumdiisopropylamid (LDA). Das resultierende Carbanion ist ein sehr starkes Nucleophil, das daher mit elektrophilen Verbindungen reagieren kann.

Oxidation von Indol
Indol ist eine Verbindung, die reich an Elektronen ist (10 Elektronen, die in den Zyklen delokalisiert sind) und leicht oxidiert werden kann . Beispielsweise ermöglicht N-Bromsuccinimid, dass Indol ( 1 ) selektiv oxidiert wird , um Oxindol ( 4 im Gleichgewicht mit 5 ) zu bilden.

Cycloadditionen
Die von den Kohlenstoffatomen in den Positionen C-2 und C-3 getragenen π-Bindungen können in Reaktionen vom Cycloadditionstyp ( Diels-Alder-Reaktion ) reagieren . Intermolekulare Reaktionen sind nicht günstig. Andererseits ermöglichen intramolekulare Reaktionen (unter Verwendung substituierter Indolderivate) gute Ausbeuten. In dem unten dargestellten Beispiel ist das Indol das Dienophil und das 2-Aminofuran das Dien .

Sicherheit
Indol kann stark mit starken Oxidationsmitteln reagieren . Es ist eine reizende Verbindung für die Augen. Wenn es verschluckt wird, reizt es Mund, Rachen, Speiseröhre und Verdauungstrakt.
Einige Indolderivate sind toxisch oder psychoaktiv (z. B. 5- (2-Aminopropyl) indol (oder 5-API oder 5-IT )).
Risikosätze und Sicherheitshinweise


- R: 21/22 (Schädlich bei Hautkontakt und beim Verschlucken)
- R: 36 (Augenreizung)
- R: 50 (Sehr giftig für Wasserorganismen)
- S: 36/37 (Geeignete Schutzkleidung und Handschuhe tragen)
- S: 61 (Vermeiden Sie die Freisetzung in die Umwelt. Beachten Sie die speziellen Anweisungen / Sicherheitsdatenblätter.)
Allgemeine Hinweise
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- (in) " Indol " auf ChemIDplus Zugriff 8. Februar 2009
- (in) Carl L. Yaws, Handbuch der thermodynamischen Diagramme: Anorganische Verbindungen und Elemente , Vol. 3, Huston, Texas, Gulf Pub. Co.,1996384 p. ( ISBN 0-88415-859-4 )
- A. Baeyer , A. Emmerling, Chemische Berichte , 2 , 679 (1869).
- Organische Synthesen, Coll. Flug. 4, S. 539; Flug. 39, S.30 Artikel
- Organische Synthesen, Coll. Flug. 6, S.104; Flug. 54, S.58 Artikel
- Bergman, J.; Venemalm, L.J. Org. Chem. 1992 , 57 , 2495 - 2497.
- Lynch, SM; Bur, SK; Padwa, A.; Org. Lette. 2002 , 4 , 4643 - 4645. Abstract
- Indoles Part One , WJ Houlihan (Hrsg.), Wiley Interscience, New York, 1972.
- JA Joule, K. Mills Heterocyclische Chemie , 4. Auflage, Blackwell Science, Oxford, UK, 2000.


