Toluol
| Toluol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur und Darstellungen von Toluol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifizierung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-Name | Toluol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyme |
methylbenzene |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,003,297 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EG | 203-625-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LÄCHELN |
Cc1ccccc1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C7H8 / c1-7-5-3-2-4-6-7 / h2-6H, 1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | farblose Flüssigkeit mit charakteristischem Geruch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute Formel |
C 7 H 8 [Isomere] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molmasse | 92,1384 ± 0,0062 g / mol C 91,25%, H 8,75%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolares Moment | 0,375 ± 0,010 D. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetische Suszeptibilität | 66,1 × 10 –6 cm 3 mol –1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekularer Durchmesser | 0,568 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° Fusion | -95 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kochen | 110,58 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Löslichkeit |
0,53 g l −1 in unendlichem Wasser in Ethanol , Aceton , Hexan , Dichlormethan |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Löslichkeitsparameter δ | 18,2 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
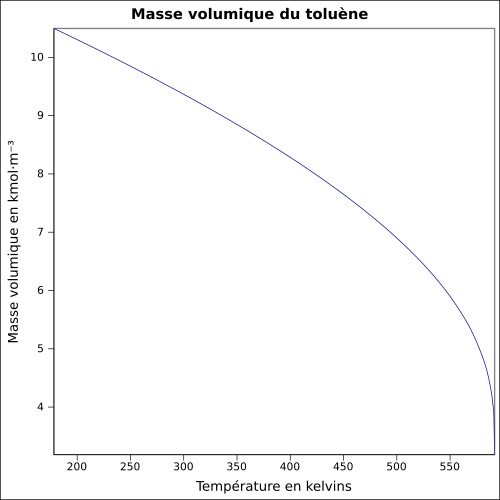
| Volumenmasse |
0,867 0 g cm –3
Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selbstentzündungstemperatur | 480 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammpunkt | 4 ° C (geschlossene Tasse) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Explosionsgrenzen in der Luft | 1,1–7,1 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sättigender Dampfdruck |
29 hPa ( 20 ° C )
Gleichung:
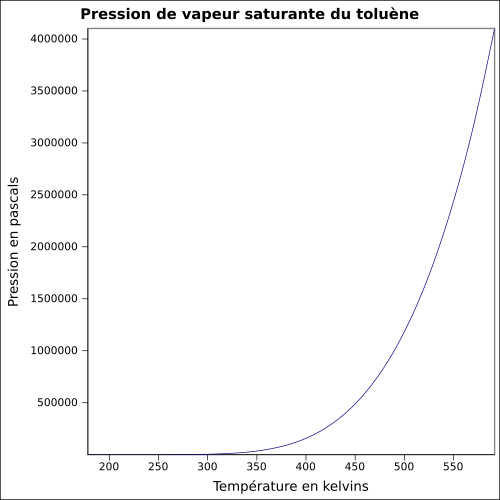
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamische Viskosität | 0,59 × 10 –3 Pa s bei 20 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kinematische Viskosität | 0,681 × 10 –6 m 2 s –1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritischer Punkt | 318,65 ° C , 41,1 bar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
Gleichung:
Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stck | 3 910,3 kJ mol –1 ( 25 ° C , flüssig) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brechungsindex | 1,4941 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vorsichtsmaßnahmen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Achtung H225, H304, H315, H336, H361d, H373, H225 : Leicht entzündbare Flüssigkeit und Dampf H304 : Kann tödlich sein beim Verschlucken und Eindringen in dem Atem H315 : Verursacht Hautreizungen H336 : Kann Schläfrigkeit und Benommenheit Mai H361d : Kann vermutlich das ungeborene zu beschädigen Kind . H373 : Verdacht auf ernsthafte Gefahr einer Organschädigung (alle betroffenen Organe auflisten , falls bekannt) nach wiederholter oder längerer Exposition ( Expositionsweg angeben , wenn eindeutig nachgewiesen ist, dass kein anderer Expositionsweg zu derselben Gefahr führt) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2A, D2B, B2 : Flammpunkt der brennbaren Flüssigkeit = 4,4 ° C geschlossener Becher Setaflash-Methode D2A : Sehr giftiges Material mit anderen toxischen Wirkungen Embryotoxizität bei Tieren D2B : Giftiges Material mit anderen toxischen Wirkungen Hautreizung bei Tieren Tier Offenlegung bei 0,1% gemäß Klassifizierungskriterien |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1294 : TOLUENE |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IARC- Klassifikation | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe 3: Nicht klassifizierbar hinsichtlich seiner Kanzerogenität für den Menschen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalation | Übelkeit, Erbrechen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 2.69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ADI | 0,22 mg / kg Körpergewicht / Tag | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Geruchsschwelle | niedrig: 0,16 ppm hoch: 37 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Einheiten von SI und STP, sofern nicht anders angegeben. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Das Toluol , auch als Methylbenzol oder Phenylmethan bekannt, ist ein aromatischer Kohlenwasserstoff . Es wird üblicherweise als Reagenz oder Lösungsmittel verwendet , insbesondere im industriellen Umfeld. Es löst eine große Anzahl von Ölen , Fetten oder Harzen (natürlich oder synthetisch). Unter normalen Bedingungen ist es eine transparente Flüssigkeit mit einem charakteristischen Geruch, der an Farbentferner oder verwandtes Benzol erinnert .
Historisch
Die Verbindung wurde erstmals 1837 durch Destillation von Kiefernöl durch den polnischen Chemiker Philippe Walter (in) isoliert, der sie " retinnapht " taufte . Im Jahr 1841 identifiziert der französische Chemiker Henri St. Clair Deville Isolate von Tolu-Balsam (en) - einem aromatischen Extrakt aus dem tropischen Baum Kolumbianisches Myroxylon-Balsam - Deville identifiziert den Rest Walter und Benzol ; Dann nennt er diesen neuen Kohlenwasserstoff „ Benzoene “. 1843 empfahl Jöns Jacob Berzelius den Namen „ Toluin “. 1850 isolierte der französische Chemiker Auguste Cahours einen Kohlenwasserstoff aus einem Holzdestillat, das er als identisch mit dem „ Benzoene “ von Deville erkannte, das er „ Toluol “ taufte .
Chemische Eigenschaften
Toluol reagiert wie ein normaler aromatischer Kohlenwasserstoff durch elektrophile aromatische Substitution . Die Methylgruppe macht es bei solchen Reaktionen ungefähr 25-mal reaktiver als Benzol . Durch Sulfonierung erhält man Paratoluolsulfonsäure , während seine Chlorierung mit Chlor in Gegenwart von Eisenchlorid ein Gemisch aus ortho- und para-Isomeren von Chlortoluol ergibt. Die Nitrierung mit Salpetersäure ergibt eine Mischung aus ortho- und para-Nitrotoluol. Beim Erhitzen ergibt die Reaktion weiterhin Dinitrotoluol und schließlich Trinitrotoluol (TNT), das explosiv ist.
Die Methylgruppe kann auch bei anderen Oxidationsreaktionen reagieren . Das Kaliumpermanganat ergibt die Benzoesäure , während das Chromylchlorid den Benzaldehyd ( der Etard-Reaktion ) ergibt . Eine Halogenierung unter radikalischen Bedingungen ergibt Benzylhalogenide. Beispielsweise wird mit N-Bromsuccinimid in Gegenwart von AIBN Benzylbromid erhalten .
Der Hydrierungskatalysator des Toluols ergibt das Methylcyclohexan . Aufgrund der besonderen Stabilität des aromatischen Systems erfordert diese Reaktion einen hohen Wasserstoffdruck .
Physikalische Eigenschaften
Toluol ist unter normalen Temperatur- und Druckbedingungen eine Flüssigkeit . Es ist nahezu unlöslich in Wasser ( 0.535 g l -1 bei 25 ° C ), aber mischbar mit vielen organischen Lösungsmitteln ( Aceton , Diethylether , Chloroform , Ethanol , usw. ), und löslich in Eisessig. .
Toluol hat eine kryoskopische Molkonstante von 3,55 ° C kg mol −1 und eine ebullioskopische Molkonstante von 3,40 ° C kg mol −1 . Sein Dampf ist schwerer als Luft und bildet mit letzterem ein explosives Gemisch.
Im Protonen-NMR tritt Toluol in Form mehrerer Peaks zwischen 7,28 ppm und 7 ppm für die Wasserstoffatome des Benzolrings und eines Singuletts bei 2,38 ppm für die Wasserstoffatome der Methylgruppe auf . Im Kohlenstoff-NMR wird Toluol in mehreren Peaks dargestellt, bei 137,8 ppm für den α-Kohlenstoff von Methyl, bei 129,09 ppm für die β-Kohlenstoffe, bei 128,28 ppm für die γ-Kohlenstoffe und bei 125,38 ppm für Kohlenstoff gegenüber Methyl. Der Kohlenstoff der Methylgruppe zeigt einen Peak bei 25 ppm .
Die Wärmeleitfähigkeit (in W · m −1 · K −1 ) beträgt 0,1425 - 0,00025 T , wobei T in ° C ausgedrückt wird .
Herstellung und Synthese
Toluol ist in Rohöl in geringem Anteil enthalten . Es wird üblicherweise durch katalytische Reformierung im Benzinherstellungsprozess hergestellt . Es wird auch durch Cracken im Ethylenherstellungsprozess oder auch aus Kohle gewonnen . Die Endreinigung erfolgt durch Destillation oder Extraktion .
Produktion
In Frankreich wurde zwischen den beiden Kriegen die Produktion in der Pulverfabrik im Nebengebäude in Salin-de-Giraud (Bouches-du-Rhône) durchgeführt. Diese Einrichtung war verantwortlich für die Behandlung aller Essenzen aus Borneo (Kampfer), die von der Pulverabteilung gekauft wurden, um das für die Herstellung von Tolit erforderliche Toluol zu extrahieren . Es war die einzige Fabrik dieser Art in Frankreich, und man kann sich die Katastrophe vorstellen, die zu ihrer Zerstörung oder einfach zu ihrer Stilllegung geführt hätte. Während des Zweiten Weltkriegs war seine Produktion für die Herstellung von starken Sprengstoffen wie TNT unerlässlich .
Die chemische Industrie der UdSSR produzierte zwischen 1940 und 1945 245.500 t dieses Produkts, zu denen 103.000 t der Alliierten hinzukamen .
Das nationalsozialistische Deutschland hatte im Dezember 1939 eine Produktion von 9.600 t geplant und im September 1944 eine Produktion von 15 500 t , hat aber schließlich diese 12 200 t produziert .
Nach Angaben der EZB produzierte die Europäische Union 2003 fast 16,75 Millionen Tonnen Toluol pro Jahr, davon 14 Millionen in Form von in Benzin eingemischten Gemischen und 2,75 Millionen in Form von kommerziellem Toluol.
Zwei der Haupthersteller dieses Produkts im Jahr 2006 sind Total Petrochemicals und EniChem . In Frankreich wurden am selben Tag 163.854 t Toluol hergestellt, 57.512 t importiert und 11.237 t exportiert.
| Vereinigte Staaten | 10.900 |
| Japan | 6.100 |
| Südkorea | 3.080 |
| China | 2,830 |
| Europäische Union | 2,040 |
| Kanada | 1.630 |
benutzen
Toluol wird verwendet:
- zur Erhöhung der Oktanzahl in Kraftstoffen , gemischt mit Benzol und Xylolen. Es ist daher in verschiedenen Erdölbrennstoffen enthalten;
- als ein Extraktionslösungsmittel
- als Lösungsmittel oder Bestandteil bei der Herstellung von Farben , Lacken, Lacken , Wachsen und Tinten ( Druck usw.);
- Ausgangsmaterial für verschiedene industrielle Prozesse : Synthese von Kautschuk , Phenol , TNT , Toluoldiisocyanat (TDI), das zur Gewinnung des Schaums aus Polyurethan , Benzol und Xylolen, Nitrotoluol, Benzylchlorid, Benzaldehyd, p- Säure- Toluolsulfon, Vinyltoluol usw. erforderlich ist. ;;
- bei der Herstellung von Klebstoffen und Klebstoffen;
- beim Gerben von Leder ;
- als Booster für die Oberflächen bestimmter Tischtennisspieler (trotz seines Verbots).
Toxikologie, Ökotoxikologie, Vorsichtsmaßnahmen und Stoffwechsel
Es ist ein schädliches und ökotoxisches Produkt (häufig in bestimmten verschmutzten Industrieböden vorhanden). Seine akute Toxizität ist gering, aber seine primären Zielorgane sind das Zentralnervensystem (Gehirn, Mark). Es ist auch reizend für Haut, Augen und Atemwege.
Bei Labortieren führt die Exposition gegenüber signifikanten Toluolspiegeln zu allgemeinen Symptomen: Hyperaktivität, Reizung der Haut und insbesondere der Schleimhäute (laufende Nase, Tränen), Reizung der Atemwege mit Atemnot. Bei Expositionswerten über 2000 ppm in der Luft ist das nächste Stadium die Narkose ( Ataxie , Verschlechterung der kognitiven Funktionen, Gleichgewichtsstörungen und neurochemische Veränderungen. Der Tod ist auf einen Atemstillstand zurückzuführen, der durch eine Erschöpfung des Zentralnervensystems hervorgerufen wird).
Die Reizung nimmt mit der Expositionsdauer und der Dosis zu: Beim Kaninchen tritt ein mäßiges Erythem auf, dann tritt nach 72 Stunden ein leichtes Ödem auf, das nach 7 Tagen irreversibel ist, und - immer beim Kaninchen - das Spülen des exponierten Auges nach 4 und 30 Sekunden Verringern Sie nicht die Intensität der Reizung.
Seine chronische Toxizität wurde an Labortieren (Maus, Ratte) untersucht, bei denen wir Folgendes beobachten:
- eine Gewichtszunahme verschiedener an der Entgiftung beteiligter Organe (Leber, Niere, z. B. nach 15-tägiger Exposition gegenüber 1250 ppm bei Ratten; bei 2500 ppm wächst die Ratte Fett mit einer Gewichtszunahme von Gehirn, Herz, Lungen und Hoden mit Symptomen von Atemnot und Ataxie);
- eine Veränderung des Spiegels der Neurotransmitter ;
- eine Neurotoxizität, die insbesondere den Hippocampus und das Kleinhirn betrifft ;
- Ototoxizität bei Ratten mit einer synergistischen Wechselwirkung mit Lärm;
- lange Belichtungszeiten (2 Jahre bei 1500 ppm ) bei Ratten einer Entzündung der Nasenschleimhaut mit Erosion der induzierten olfaktorischen Epithels , Metaplasie und Degeneration des respiratorischen Epithels, aber unterhalb von 300 ppm wurden keine Symptome beobachtet. wurde beobachtet (die NOAEL- oder Konzentration ohne Die beobachtete toxische Wirkung betrug 625 ppm bei einer Exposition von 6,5 Stunden pro Tag, 5 Tagen pro Woche für 15 Wochen oder 300 ppm über einen Expositionszeitraum von 2 Jahren. Oral betrug der NOAEL für Ratten und Mäuse 625 mg kg –1 d - 1 für 13 Wochen).
Toluol scheint in vivo keine Auswirkungen auf die DNA zu haben , während dies in vitro der Fall ist .
Über die Haut oder durch Einatmen scheint es nicht krebserregend zu sein , aber als Lösungsmittel könnte es zum Eintritt krebserregender Produkte in den Körper beitragen.
Toluol ist reprotoxisch (beeinträchtigte die Fruchtbarkeit bei Ratten, bei denen es für die Mutter nicht toxisch ist). Es beeinträchtigt auch die männliche Fruchtbarkeit durch eine Veränderung der Spermatogenese und / oder möglicherweise der Funktion des Nebenhodens: 20% weniger Spermatozoen ohne Verringerung ihrer Mobilität unter 6000 ppm . Darüber hinaus nimmt die Anzahl der Spermien sowie deren Mobilität ab, jedoch ohne Veränderung des Hodengewichts oder der Hodenspermatogenese und ohne Veränderung des Hormonspiegels nach einem Monat Exposition [17]. Die Fruchtbarkeit wird unter 600 ppm nicht beeinträchtigt .
Es gelangt leicht in den Embryo und induziert bei Tieren über 600 ppm (keine Daten für den Menschen) eine Verzögerung des Wachstums und des Gewichts bei der Geburt sowie postnatale psychomotorische Störungen, die die Neurotoxizität von Toluol für das embryonale Gehirn widerspiegeln, jedoch ohne äußere Missbildungen, auch durch Inhalation . Es ist nicht bekannt, dass es in vivo oder in vitro teratogen ist . Die EU hat es als reproduktionstoxisch eingestuft, Kategorie 3 , R 63 .
Kinetik im Körper
Selbst in flüssiger Form passiert es die Hautbarriere schlecht (14 bis 23 mg / cm 2 pro Stunde) und in Dampfform noch weniger (4,6 μg / cm 2 pro Stunde für Nacktmäuse , die 1000 ppm ausgesetzt waren , während Rattenhaut in vitro absorbiert 0,78 & mgr; g / cm 2 pro Minute.).
Es passiert jedoch leicht die Lungenschleimhaut in beide Richtungen (10 bis 20% des aufgenommenen und / oder eingeatmeten Toluols werden dann über das Ausatmen in Form von Dampf ausgeschieden). Der Gehalt an ausgeatmetem Benzol steigt nach Einnahme von Ethylalkohol an , wobei letzterer den Metabolismus von Toluol hemmt, wodurch dessen Ausscheidung im Urin verringert wird.
Das Einatmen von Toluoldämpfen ist schädlich. In hohen Dosen verursacht es Übelkeit . Eine chronische Langzeitinhalation von Toluol führt zu irreversiblen Hirnschäden . Aus der Lunge wird es vom Blut transportiert, das zur Hälfte an Hämoglobin und zur Hälfte im Serum gebunden ist (beim Menschen; bei Ratten wird es hauptsächlich im Serum transportiert). Es ist 10 bis 15 Minuten nach Beginn der Exposition im Blut nachweisbar (mit einer Geschwindigkeit, die umso höher ist, je höher der Benzolspiegel in der Atemluft war; der Absorptionsgrad (ungefähr 50% der Konzentration) hängt auch von der ab Rate der Lungenventilation . Wir können daher , dass Jogger übernehmen in der Nähe einer Hauptachse der Zirkulation laufen mehr ausgesetzt wird es geht schnell durch das Gehirn. experimentell exponierten Ratten im Blut 53 einen Peak zeigen min nach der Belichtung und 5 min später (58 min ) im Gehirn (reich an Fettgewebe . ) es ist auch im Knochenmark gefunden Knochen und spinalen , dem Fettgewebe , der Leber und den Nieren .
Toluol wird auch über den Magen-Darm-Trakt sehr gut resorbiert; mit (bei Menschen und Ratten) einem nachweisbaren Peak im Blut ungefähr zwei Stunden nach der Einnahme.
Es wird kaum durch die Plazentaschranke gefiltert; Bei Ratten beträgt die Konzentration im Fötus etwa 75% der im mütterlichen Blut. Muttermilch, falls vorhanden, ermöglicht auch die Übertragung von der Mutter auf das Kind (bei Menschen und Tieren).
Die Toxizität von Toluol erklärt sich aus seinem Metabolismus . Da Toluol in Wasser sehr schlecht löslich ist, kann es den Körper auf herkömmliche Weise (Urin, Kot, Schweiß) nicht verlassen. Es muss metabolisiert werden, um ausgeschieden zu werden . Die Methylgruppe von Toluol oxidiert leichter als der aromatische Ring. Diese Reaktion wird in der Leber durch Cytochrom P450- Monooxygenasen durchgeführt . Infolgedessen werden 95% des Toluols in Benzylalkohol umgewandelt . Es sind die verbleibenden 5%, die die toxischen Metaboliten, die Epoxide des aromatischen Kerns , erzeugen . Die große Mehrheit dieser Epoxide ist an Glutathion konjugiert , jedoch schädigt das Wenige, das entkommen kann, die zelluläre Maschinerie ernsthaft, indem es bestimmte Proteine , sogar die DNA , alkyliert .
Toluol wird hauptsächlich über den Urin als Benzoesäure - erhalten durch enzymatische Oxidation von Benzylalkohol - und als Hippursäure ausgeschieden, die durch Konjugation von Benzoesäure mit Glycin erhalten wird .
Synergien
Viele Synergien sind wahrscheinlich, da Toluol ein starkes Lösungsmittel ist. Es ist zum Beispiel bekannt, dass die Toluol- Xylol- Kombination durch metabolische Konkurrenz einen Anstieg des Toluolspiegels (Blut und Gehirn) induziert.
Verbindliche Grenzwerte für die berufliche Exposition
In Frankreich sind sie 20 ppm oder 77 mg m -3 (8 h) und 100 ppm 384 mg m -3 (für Belichtung kurzfristiger oder 15 min ) nach der Verordnung hergestellt n o 2012-746 von9. Mai 2012. Diese Werte werden insbesondere zur Herstellung von Regulierungs Dosimetrie bestimmt durch die Verordnung n o 2009-1570 von15. Dezember 2009.
Anmerkungen und Referenzen
- TOLUENE , Sicherheitsblatt (e) des Internationalen Programms zur Sicherheit chemischer Substanzen , konsultiert am 9. Mai 2009
- (in) David R. Lide, Handbuch für Chemie und Physik , Boca Raton, CRC,16. Juni 2008, 89 th ed. 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 9-50
- (in) Hyp J. Daubensee Jr. , James D. Wilson und John L. Laity, " Erhöhung der diamagnetischen Suszeptibilität in Kohlenwasserstoffen " , Journal of American Chemical Society , Vol. 3, No. 91, n o 8,9. April 1968, p. 1991-1998
- (in) Yitzhak Marcus, Die Eigenschaften von Lösungsmitteln , vol. 4, England, John Wiley & Sons ,1999239 p. ( ISBN 0-471-98369-1 ) , p. 85
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- (in) Iwona Owczarek und Krystyna Blazej, " Empfohlene kritische Temperaturen. Teil II. Aromatische und cyclische Kohlenwasserstoffe “ , J. Phys. Chem. Ref. Data , vol. 33, n o 230. April 2004, p. 541 ( DOI 10.1063 / 1.1647147 )
- (in) James E. Mark, Handbuch für physikalische Eigenschaften von Polymeren , Springer,2007, 2 nd ed. 1076 p. ( ISBN 978-0-387-69002-5 und 0-387-69002-6 , online lesen ) , p. 294
- (in) JG Speight und Norbert Adolph Lange , Langes Handbuch der Chemie , McGraw-Hill,2005, 16 th ed. 1623 p. ( ISBN 0-07-143220-5 ) , p. 2,289
- (en) Robert H. Perry und Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- Technische Ingenieurausgaben, Artikel B 1201
- " Eigenschaften verschiedener Gase " auf flexwareinc.com (abgerufen am 12. April 2010 )
- (in) Carl L. Yaws, Handbuch der thermodynamischen Diagramme: Organische Verbindungen C8 bis C28 , vol. 2, Huston, Texas, Gulf Pub.,1996396 p. ( ISBN 0-88415-858-6 )
- (in) David R. Lide , CRC-Handbuch für Chemie und Physik , Boca Raton, CRC Press,18. Juni 2002, 83 th ed. 2664 p. ( ISBN 0849304830 , Online-Präsentation ) , p. 5-89
- " ESIS " (abgerufen am 6. Dezember 2008 )
- IARC-Arbeitsgruppe zur Bewertung krebserzeugender Risiken für den Menschen, " Bewertungen Globales de la Carcinogenicité pour l'Homme, Gruppe 3: Nicht klassifizierbar hinsichtlich ihrer Kanzerogenität für den Menschen " , in Monographien.iarc.fr , IARC,16. Januar 2009(abgerufen am 22. August 2009 )
- Index Nummer in Tabelle 3.1 des Anhangs VI der EG - Verordnung 1272/2008 (16. Dezember 2008)
- " Toluol " in der Datenbank der Chemikalien Reptox der CSST (Quebec Organisation, die für Sicherheit und Gesundheitsschutz am Arbeitsplatz zuständig ist), abgerufen am 25. April 2009
- Akzeptable tägliche Konzentrationen / Aufnahme und tumorigene Konzentrationen / Dosen prioritärer Substanzen, berechnet nach Gesundheitskriterien , veröffentlicht von Health Canada
- " Toluol " unter hazmap.nlm.nih.gov (abgerufen am 14. November 2009 )
- Pelletier und Walter (1837) "Übersicht über Produkte aus der Harzverarbeitung bei der Herstellung von Gas für Beleuchtungszwecke" , Proceedings , 4 : 898–899.
- Pelletier und Philippe Walter (1838) "Untersuchung der Produkte, die aus der Behandlung von Harz bei der Herstellung von Gas für die Beleuchtung resultieren", Annales de Chimie et de Physique , 2. Reihe, 67 : 269-303. Toluol heißt pp. 278-279: „Wir werden die Substanz, die uns betrifft , mit dem Namen retinnaphtus bezeichnen , der an ihren Ursprung und seine physikalischen Eigenschaften erinnert (ρητίνη-νάφτα). ""
- Deville (1841) " Untersuchungen von Harzen. Untersuchung von Tolu-Balsam", Proceedings , 13 : 476–478.
- H. Deville (1841) " Chemische Untersuchungen von Harzen; Erste Memoiren" (Chemische Untersuchungen von Harzen; Erste Memoiren), Annales de Chimie et de Physique , 3. Reihe, 3 : 151-195. Deville nennt Toluol auf S. 170: „Ich habe für den Körper, der mich in diesem Moment betrifft , den Namen Benzol übernommen , der in den Balsamen, aus denen es stammt, an diesen fast generischen Charakter erinnert, der Benzoesäure enthalten soll. ""
- Jaime Wisniak , „ Henri Étienne Sainte-Claire Deville: Ein Arzt wurde Metallurge “, Journal of Materials Engineering and Performance , vol. 13, n o 22004, p. 117–118 ( DOI 10.1361 / 10599490418271 , Bibcode 2004JMEP ... 13..117W )
- Jacob Berzelius (1843) Jahresberichte , 22 : 353-354. .
- Cahours, Auguste (1850) "Forschung zu Leichtölen, die bei der Destillation von Holz gewonnen werden" (Untersuchungen von Leichtölen, die bei der Destillation von Holz gewonnen werden), Berichte , 30 : Seite 320
- Jaime Wisniak (Oktober 2013) "Auguste André Thomas Cahours", Educación Química , 24 (4): 451–460.
- Die Wirtschaft der UdSSR in den Jahren 1941-1945
- (in) Anhang D. Strategischer Luftangriff auf die Pulver- und Sprengstoffindustrie: Tabelle D6 Anlagen zur Herstellung von Rohstoffen für Pulver und Sprengstoffe
- INERIS - Technische und wirtschaftliche Daten zu chemischen Substanzen in Frankreich: Toluol [PDF]
- Aromatische Kohlenwasserstoffe , Französische Gesellschaft für Chemie
- Campo P. et al. , Hörverlust-toluol induziert: Eine Mittenfrequenz Lage der Cochlea - Läsionen , Neurotoxicology und Teratology , 1997, 19: 129-40.
- Søren Lund und Gitte Kristiansen , „ Gefahren für das Hören durch kombinierte Exposition gegenüber Toluol und Lärm bei Ratten “, International Journal of Occupational Medicine and Environmental Health , vol. 21, n o 1,1 st Januar 2008( ISSN 1896-494X und 1232-1087 , DOI 10.2478 / v10001-008-0008-x , online gelesen , abgerufen am 26. Februar 2019 )
- R. Lataye und P. Campo , " Kombinierte Auswirkungen einer gleichzeitigen Exposition gegenüber Lärm und Toluol auf die Hörfunktion ", Neurotoxicology and Teratology , vol. 19, n o 5,September 1997, p. 373–382 ( ISSN 0892-0362 , PMID 9380004 , online gelesen , abgerufen am 26. Februar 2019 )
- Guillot J.-P. et al. , Bewertung des Hautreizungspotentials von 56 Verbindungen , Food and Chemical Toxicology , 1982, 20: 563-572.
- Guillot J.-P. et al. , Bewertung des Augenreizungspotentials von 56 Verbindungen , Food and Chemical Toxicology , 1982, 20: 573-582.
- Zusammenfassung der Toxizität für Toluol. Toxizitätsprofile, Risk Assessment Information System , 1994. Verfügbar unter http://risk.lsd.ornl.gov/tox/rap_toxp.shtml
- Toxikologie- und Karzinogenese-Studien von Toluol (CAS-Nr. 108-88-3) an F344 / N-Ratten und B6C3F1-Mäusen (Inhalationsstudien) , Toxicity Review TR-371, NTP, 1990. Link NIEHS
- Toluol . In: IARC-Monographien zur Bewertung krebserzeugender Risiken für den Menschen , Lyon: IARC, 1999, 71 (2); 829-864.
- Toxikologie- und Karzinogenese-Studien von Toluol (CAS-Nr. 108-88-3) an F344 / N-Ratten und B6C3F1-Mäusen (Inhalationsstudien) , Toxicity Review TR-371, NTP; 1990. NIEHS-Website
- Toluol , Toluolfolie von DEMETER. Dokumente zur medizinischen Bewertung von reproduktionstoxischen Produkten , INRS, 2006
- Dalgaard M. et al. , Entwicklungstoxizität von Toluol bei männlichen Ratten: Auswirkungen auf die Samenqualität, die Hodenmorphologie und die apoptotische Neurodegeneration , Archives of Toxicology , 2001, 75 (2): 103-109.
- Wilkins-Haug L., Teratogen-Update: Toluol , Teratology , 1997, 55: 145-151.
- Ono A. et al. , Toluol-Inhalation induzierte eine epididymale Spermienfunktionsstörung bei Ratten , Toxicology , 1999, 139 (3): 193–205.
- INRS-Toxikologieblatt, zugänglich über die externen Links auf dieser Seite
Siehe auch
Zum Thema passende Artikel
- Xylol , Benzol mit zwei Methylgruppen
- Nitrotoluol , Toluol, substituiert mit einer Nitrogruppe
- Dinitrotoluol , Toluol, substituiert durch zwei Nitrogruppen
- Trinitrotoluol Toluol substituiert durch drei Nitrogruppen
- Toluidin , Toluol, substituiert mit einer Amingruppe
Externe Links
- Toxikologisches Blatt , INRS.
- Biotox-Datenbank , INRS.
- Internationales Sicherheitsdatenblatt unter www.cdc.gov .