Kohlensäure
Sie können helfen , es zu verbessern oder Probleme auf der Diskussionsseite zu diskutieren .
- Dieser Artikel zitiert keine Quelle und enthält möglicherweise falsche Informationen. Wenn Sie Nachschlagewerke oder Artikel haben oder über hochwertige Websites verfügen, die sich mit dem hier behandelten Thema befassen, vervollständigen Sie den Artikel, indem Sie die für die Überprüfbarkeit nützlichen Referenzen angeben und sie mit dem Abschnitt " Notizen " und Referenzen verknüpfen . (Markiert seit April 2019)
- Bing
- Cairn
- DuckDuckGo
- E. Universalis
- Gallica
- G. Bücher
- G. Nachrichten
- G. Scholar
- Perseus
- Qwant
- (zh) Baidu
- (ru) Yandex
- (wd) finde Arbeiten zu Kohlensäure
| Kohlensäure | |
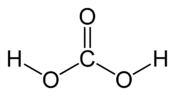  Struktur der Kohlensäure. |
|
| Identifizierung | |
|---|---|
| IUPAC-Name |
Kohlensäure Hydrogencarbonat |
| N o CAS | |
| N o ECHA | 100, 133, 015 |
| N o EG | 610-295-3 |
| PubChem | 767 |
| ChEBI | 28976 |
| LÄCHELN |
C (= O) (O) O , |
| InChI |
InChI: InChI = 1S / CH2O3 / c2-1 (3) 4 / h (H2,2,3,4) InChIKey: BVKZGUZCCUSVTD-UHFFFAOYSA-N |
| Chemische Eigenschaften | |
| Brute Formel | H 2 C O 3 |
| Molmasse | 62,0248 ± 0,0018 g / mol C 19,36%, H 3,25%, O 77,39%, |
| pKa | 6,37 und 10,32 (Disäure) |
| Physikalische Eigenschaften | |
| Löslichkeit | Boden. im Wasser |
| Kristallographie | |
| Kristallklasse oder Raumgruppe | P213 |
| Netzparameter |
a = b = c = 8.600 Å α = β = γ = 90,00 ° |
| Volumen | 636,06 Å 3 |
| Einheiten von SI und STP, sofern nicht anders angegeben. | |
Die Kohlensäure ist eine chemische Verbindung der Formel H 2 CO 3. Es ist eine schwache Säure, deren konjugierte Basen die Anionen HCO 3 - sind.( Bicarbonat ) und CO 3 2-( Carbonat ). Es entsteht in Wasser insbesondere durch Solvatisierung von Kohlendioxid :
CO 2 (aq)+ H 2 O (l) H 2 CO 3 (aq),mit einem konstanten Gleichgewicht der Hydratisierung werden im Wert K H = [H 2 CO 3] / [CO 2] ≈ 1,70 × 10 -3 bei 25 ° C , was bedeutet, dass Kohlensäure ein instabiles Molekül ist, wobei nur sehr wenige Kohlendioxidmoleküle tatsächlich zu Kohlensäure hydratisiert werden, wie in kohlensäurehaltigem Wasser und im Blut .
Säure
In wässriger Lösung Kohlensäure H 2 CO 3ist eine Disäure , d. h. sie kann zweimal hintereinander in Wasser dissoziieren, wobei jedes Mal ein Proton in Form eines H 3 O + -Kations freigesetzt wird ::
H 2 O.+ H 2 CO 3→ H 3 O ++ HCO 3 - : pK a1 = 6,37. H 2 O.+ HCO 3 -→ H 3 O ++ CO 3 2- : pK a2 = 10,32.Wenn Kohlensäure mit einem Kation kombiniert wird , können sich Salze bilden, die als Bicarbonate und Carbonate bezeichnet werden. In Kombination mit Kalk ( Calciumhydroxid ) bildet es beispielsweise Calciumcarbonat (Hauptbestandteil von Kalkstein, Kreide ).
Rolle
Natürlich
Mit dem Anstieg der CO 2 -Emissionen in der Atmosphäre können wir eine Versauerung der Ozeane feststellen ;
CO 2 + H 2 O → H 2 CO 3
Wasser bildet Kohlensäure durch Mischen mit dem von den Ozeanen absorbierten CO 2 . Diese Säure löst Calciumcarbonat , die Hauptverbindung in Schalentieren (das Plankton selbst leidet aus dieser Ansäuerung).
In verdünnter Form spielt es eine wichtige Rolle bei der Bildung von Höhlen .
Nahrungsmittelindustrie
Kohlensäure ist in alkoholfreien Getränken enthalten . In Wasser bildet CO 2 Kohlensäure, die die Zunge kribbelt, den Geschmack verbessert und als mildes Bakterizid wirkt. Es aktiviert den Durchgang von Nahrungsmitteln vom Magen zum Darm.
Es wurde zur Konservierung von Fleisch verwendet .
Derivate
Kohlensäure hat viele Derivate, Beispiele:
- Carbaminsäuren ;
- Carbamide oder Harnstoffe;
- Carbamate oder Urethane;
- Phosgen .
Anmerkungen und Referenzen
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- „ Kohlensäure “ unter www.reciprocalnet.org (abgerufen am 12. Dezember 2009 )
