Swern Oxidation
Die Swern-Oxidation ist die Oxidationssüßigkeit von primären und sekundären Alkoholen in Aldehyd und Keton in einem Medium, das Oxalylchlorid , Dimethylsulfoxid und Triethylamin enthält .
Der Hauptvorteil dieser Methode liegt in den milden Bedingungen, die die Verwendung toxischer Reagenzien ( Oxalylchlorid , Dimethylsulfoxid, Freisetzung von Kohlenmonoxid ) kompensieren . Es ist weiterhin unmöglich, die zusätzliche Oxidation zu Carbonsäure im Falle der Oxidation eines primären Alkohols zu beobachten. Diese Methode wird sehr häufig bei der Totalsynthese von Naturstoffen eingesetzt.
Die Nebenprodukte sind Dimethylsulfid (Me 2 S), Kohlenmonoxid (CO), Kohlendioxid (CO 2 ) und - wenn Triethylamin als Base verwendet wird - Triethylammoniumchlorid (Et 3 NHCl). Zwei von ihnen, Me 2 S und CO, sind sehr giftig und flüchtig: Die Reaktion muss daher unter einer Haube durchgeführt werden. Me 2 S ist eine flüchtige Flüssigkeit (T eb = 37 ° C ) mit einem unangenehmen Geruch: Eine Möglichkeit, diesen Geruch zu begrenzen, besteht darin, ihn mit Ozon zu behandeln, um ihn in geruchloses Dimethylsulfoxid umzuwandeln .
Mechanismus
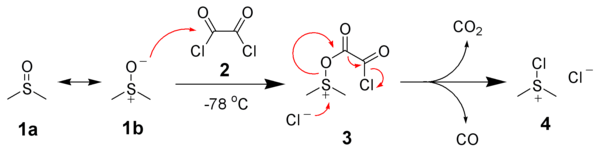
Der erste Schritt bei der Swern - Oxidation ist die Reaktion, bei niedriger Temperatur, von Dimethylsulfoxid (DMSO) 1a und 1b mit Oxalylchlorid , 2 . Das erste Zwischenprodukt, 3 , zersetzt sich schnell, die Freigabe Kohlenoxide (CO und CO 2 ) und zum Erzeugen dimethylchlorosulfonium Chlorid , 4 .
Nach Zugabe des Alkohols 5 reagiert das Dimethylchlorsulfoniumchlorid 4 mit dem Alkohol unter Bildung des ionischen Zwischenprodukts Alkoxysulfonium 6 . Die Zugabe von zwei Äquivalenten Base - typischerweise dem Triethylamin - deprotoniert das Ionenalkoxysulfonium, um das Ylid des Schwefels zu ergeben , 7 . In einem Übergangszustand einen 5-gliedrigen Ring umfasst, wobei die Schwefel - Ylid zersetzt zu geben Dimethylsulfid (Me 2 S) und der gewünschte Aldehyd oder Keton , 8 .

Varianten
Bei Verwendung von Oxalylchlorid als Dehydratisierungsmittel sollte die Reaktion auf einer Temperatur unter –60 ° C gehalten werden , um Nebenreaktionen zu vermeiden. Durch Verwendung von Trifluoressigsäureanhydrid anstelle von Oxalylchlorid kann die Temperatur ohne Nebenreaktionen auf –30 ° C erhöht werden . DMSO kann auch aktiviert werden, um die Bildung des Zwischenprodukts 6 mit Carbodiimiden ( Pfitzner-Moffatt-Oxidation ) oder einem Schwefeltrioxid-Pyridin- Komplex ( Parikh-Doering-Oxidation ) zu initiieren .
In einigen Fällen kann die Verwendung von Triethylamin als Base zur Epimerisierung des α-Kohlenstoffs aus dem neu gebildeten Carbonyl führen. Die Verwendung von Diisopropylethylamin (i-Pr 2 NEt, Hünig-Base), das sperriger ist, kann diesen unerwünschten Effekt abschwächen.
Hinweis
Das Dimethylsulfid -Nebenprodukt dieser Reaktion hat einen sehr unangenehmen Geruch. Die menschlichen Riechdrüsen sind außerdem in der Lage, diese Verbindung in Konzentrationen in der Größenordnung von einigen Teilen pro Milliarde nachzuweisen. Eine einfache Lösung für dieses lästige Problem besteht darin, Glaswaren mit Bleichmittel zu spülen , das Dimethylsulfid oxidieren und so den Geruch beseitigen kann.