Chlor
| Chlor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chlor in einer Ampulle. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifizierung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-Name | Chlor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,029,053 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EG | 231-959-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E. | E925 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | grünlich-gelbes Gas, stechender Geruch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute Formel |
Cl 2 [Isomere] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molmasse | 70,906 ± 0,004 g / mol Cl 100%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° Fusion | −101 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kochen | -34,6 ° C. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Löslichkeit |
14,6 g · l -1 in Wasser bei 0 ° C , 7,3 g · l -1 bei 20 ° C , 5,7 g · l -1 bei 30 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
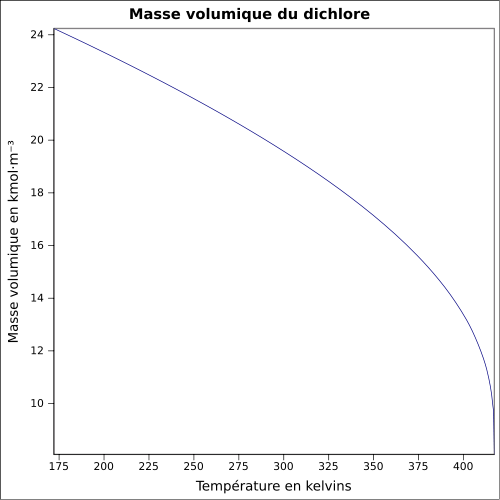
| Volumenmasse | 2,48 (Dichte bezogen auf Luft) bei 20 ° C , 6.864 atm : 1.4085 g · cm -3 (liq.) Bei -35 ° C , 0,9949 atm : 1,5649 g · cm - 3 (Liq . ) Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
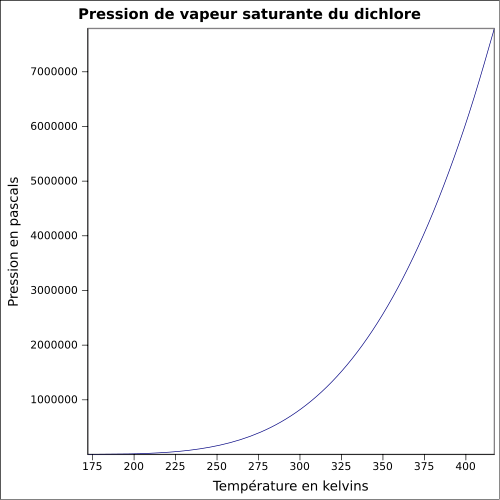
| Sättigender Dampfdruck |
6,776 bar bei 20 ° C 8,8 bar bei 30 ° C 14,3 bar bei 50 ° C. Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritischer Punkt |
143,81 ° C 79,914 bar 0,57688 kg · s -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dreifacher Punkt |
–100,98 ° C 0,01387 bar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 206 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
20.41 kJ · mol -1 ( 1 atm , -34,04 ° C ); 17.65 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
Gleichung:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronische Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re lonisierungsenergie | 11,480 ± 0,005 eV (Gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallographie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pearson-Symbol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallklasse oder Raumgruppe | CMCA ( n o 64) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Strukturbericht | A14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Typische Struktur | I 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vorsichtsmaßnahmen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Achtung H270, H315, H319, H331, H335, H400, H270 : Kann Feuer verursachen oder verstärken ; Oxidationsmittel H315 : Verursacht Hautreizungen H319 : Verursacht schwere Augenreizung H331 : Giftig bei Einatmen H335 : Mai Ursache Reizung der Atemwege H400 : Sehr giftig für Wasserorganismen |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Absoluter Dampfdruck des Druckgases bei 50 ° C = 750 kPa D1A : Sehr giftiges Material mit schwerwiegenden unmittelbaren Auswirkungen Transport gefährlicher Güter: Klasse 2.3 E : Ätzendes Material Transport gefährlicher Güter: Klasse 8 Offenlegung bei 1,0% gemäß Angaben zum Inhaltsstoff Liste Kommentare: Wie in der Auslegung einer Gesundheitspolitik in Kanada dargestellt, muss das Gefahrensymbol D1 (Schädel) nicht auf dem Etikett des Lieferanten erscheinen. Alle von diesem Produkt ausgehenden Gesundheits- und Sicherheitsrisiken müssen jedoch auf dem Etikett und dem Sicherheitsdatenblatt angegeben werden. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 4 0 OCHSE | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
265 : giftiges und oxidierendes Gas (fördert das Feuer) UN-Nummer : 1017 : CHLOR Klasse: 2.3 Klassifizierungscode: 2TOC : Verflüssigtes, giftiges, oxidierendes, ätzendes Gas. Etiketten: 2.3 : Giftige Gase (entspricht den durch ein Großbuchstaben T bezeichneten Gruppen, d. H. T, TF, TC, TO, TFC und TOC). 5.1 : Oxidierende Substanzen 8 : Ätzende Substanzen    |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalation | erstickender Geruch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 1 Stunde: Ratte 293 ppm Maus 137 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Geruchsschwelle | niedrig: 0,02 ppm hoch: 3,4 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Einheiten von SI und STP, sofern nicht anders angegeben. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Das Chlor ( Cl 2 ) ist ein Gas gelb-grün in Normalbedingungen für Temperatur und Druck ( chloros Mittel „grüner“ in Greek ). Es ist 2,5-mal dichter als Luft . Es hat einen sehr unangenehmen erstickenden Geruch und ist extrem giftig, da es sich mit Feuchtigkeit in den Schleimhäuten und Lungen zu Säuren rekombiniert , die das Gewebe angreifen.
Chlor wurde durch entdeckt Carl Wilhelm Scheele in 1774 . Es wurde im Ersten Weltkrieg als Kampfgas , Bertholite, verwendet .
Chlor ist in Wasser löslich und bildet Chlorwasser , in Salzwasser jedoch nicht.
Das Molekül Chlor aus zwei gebildeten Atom von Chlor .
Produktion
Das Chlor kann leicht durch Elektrolyse einer Natriumchloridlösung ( Chloralkali-Verfahren ) hergestellt werden:
2Na + + 2Cl - + 2H 2 O.→ 2NaOH + Cl 2 + H 2Scheele synthetisierte es durch Umsetzung von Mangandioxid (MnO 2 ) mit Salzsäure (HCl).
Es kann auch in kleinen Mengen durch Umsetzung von Salzsäure mit Kaliumpermanganat hergestellt werden .
Wenn eine Säure in Bleichmittel gegossen wird , wird zusätzlich eine Freisetzung von Chlor beobachtet (aber in Gegenwart von Harnstoff, der im Urin vorhanden ist, gibt es Trichloramin (NCl 3 ) ab; sehr reizendes Gas). Der chlorometrische Grad einer Bleichlösung ist das Volumen an Chlor, das von einem Liter dieser Lösung (überschüssige Säure) freigesetzt wird.
Cl - > + ClO - + 2H + → Cl 2 + H 2 O.benutzen
Chlor wird als Rohstoff zur Herstellung von Salzsäure durch Reaktion zwischen Chlor und Diwasserstoff verwendet .
Cl 2 + H 2 → 2HClEs wird auch zur Herstellung von Polyvinylchlorid (PVC) verwendet.
Es wird zur Herstellung von Produkten mit einer Kohlenstoff-Chlor-Bindung verwendet, wie beispielsweise dem Kältemittel R12- Dichlordifluormethan .
Es dient auch zur Desinfektion des Trinkwassers anstelle des Bleichmittels .
Es wurde während des Ersten Weltkriegs als Kampfgas verwendet (weil es die oberen Atemwege reizt und giftig ist), wo es fünftausend Tote und fünfzehntausend Überlebende hinterließ und die Opfer in den meisten Fällen lebenslange Folgen hatte .
Eigenschaften
Chlor hat die Eigenschaft, die Lösung von Indigo und mehreren anderen organischen Substanzen zu verfärben. Die Farbe vieler organischer Farbstoffe ergibt sich aus den Unterschieden zwischen den vielen Energieniveaus ihrer konjugierten Bindungen . Chlor oxidiert jedoch die Kohlenstoff-Kohlenstoff-Doppelbindungen, die die konjugierten Bindungssysteme bilden.
Verweise
- CHLOR , Sicherheitsblatt (e) des Internationalen Programms zur Sicherheit chemischer Substanzen , konsultiert am 9. Mai 2009
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- (en) Robert H. Perry und Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- (in) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. 2610 p. ( ISBN 978-1-4398-2077-3 ) , p. 14-40
- (in) David R. Lide, CRC-Handbuch für Chemie und Physik , CRC Press,2009, 90 th ed. 2804 p. , Gebundene Ausgabe ( ISBN 978-1-4200-9084-0 )
- (in) David R. Lide, Handbuch für Chemie und Physik , Boca Raton, CRC,2008, 89 th ed. 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- " Die molekulare Jod (I2) -Kristallstruktur (A14) " unter http://cst-www.nrl.navy.mil/ (abgerufen am 17. Dezember 2009 )
- Indexnummer in Tabelle 3.1 des Anhangs VI der EG - Verordnung n o 1272/2008 (16. Dezember 2008)
- " Chlor " in der Datenbank der Chemikalien Reptox der CSST (Quebec Organisation, die für Sicherheit und Gesundheitsschutz am Arbeitsplatz zuständig ist), abgerufen am 25. April 2009
- " Chlor " unter hazmap.nlm.nih.gov (abgerufen am 14. November 2009 )
- " Datei: Bleichmittel - Wässrige Lösung von Natriumhypochlorit " [PDF] , National Chamber of Bleach, Mai 2010, p. 8 , § 7: Sicherheit für den Menschen, auf eaudejavel.fr
- " Exposition von Einzelpersonen und Gruppen gegenüber Chlordämpfen ", Belgisches Giftzentrum
- " Gas: 22. April 1915 in Ypern (Belgien) " über den Ersten Weltkrieg
- Chemie, obligatorisches S-Terminal, Programm 2002 , Nathan, Slg. "Sirius",2008351 p. ( ISBN 978-2-09-172496-6 ) , p. 248