Pentaboran
| Pentaboran | |||
| |||
 | |||
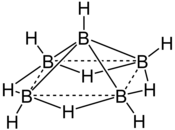
| Struktur von Pentaboran (9) | |||
| Identifizierung | |||
|---|---|---|---|
| IUPAC-Name | nido- pentaboran (9) | ||
| Synonyme |
stabiles Pentaboran, 2,3: 2,5: 3,4: 4,5-tetra-μ H - nido- pentaboran (9) |
||
| N o CAS | |||
| N o ECHA | 100.039.253 | ||
| N o EG | 243-194-4 | ||
| N o RTECS | RY8925000 | ||
| ChEBI | 33591 | ||
| LÄCHELN |
[H] [B] 123 [B] 456 ([H]) [H] [B] 141 ([H]) [H] [B] 211 ([H]) [H] [B] 351 ([H ]) [H] 6 , |
||
| InChI |
Std. InChI: InChI = 1S / B5H9 / c6-2-1-3 (2,6) 5 (1,8-3) 4 (1,2,7-2) 9-5 / h1-5H Std. InChIKey: XPIBKKWNZBDJNI-UHFFFAOYSA-N |
||
| Aussehen | farblose Flüssigkeit mit stechendem Geruch. | ||
| Chemische Eigenschaften | |||
| Formel | B 5 H 9 | ||
| Molmasse | 63,126 ± 0,036 g / mol H 14,37 %, B 85,63 %, |
||
| Dipolares Moment | 2,13 ± 0,04 D | ||
| Physikalische Eigenschaften | |||
| T ° Fusion | −47 °C | ||
| T ° Kochen | 60 °C | ||
| Löslichkeit | in Wasser: Reaktion | ||
| Volumenmasse | 0,6 g · cm -3 | ||
| Selbstentzündungstemperatur | ~ 35 °C | ||
| Flammpunkt | 30 °C (geschlossene Tasse) | ||
| Explosionsgrenzen in Luft | 0,42 - 98 % vol | ||
| Sättigungsdampfdruck | 22,8 kPa bei 20 °C | ||
| Vorsichtsmaßnahmen | |||
| WHMIS | |||
  B2, B6, D1A, D2B, B2 : Entzündbare Flüssigkeit B6 : Entzündbares reaktives Material D1A : Sehr giftiges Material mit sofortiger schwerwiegender Wirkung D2B : Giftiges Material mit sonstiger toxischer Wirkung Angabe bei 1,0% gemäß Inhaltsstoffliste |
|||
| NFPA 704 | |||
| 4 4 4 | |||
| Transport | |||
333 : pyrophore Flüssigkeit UN-Nummer : 1380 : PENTABORAN Klasse: 4.2 Klassifizierungscode: ST3 : Selbstentzündliche Stoffe, giftig: Anorganisch, giftig, flüssig; Labels: 4.2 : Stoffe geeignet zur Selbstentzündung 6.1 : Giftige Stoffe Verpackung: Verpackungsgruppe I : sehr gefährliche Stoffe;   |
|||
| Einheiten von SI und STP, sofern nicht anders angegeben. | |||
Das Pentaboran , auch genannt Pentaboran permanent und Pentaboran (9) aus zu unterscheiden , Pentaboran (11) ist ein Hydrid des Bors der chemischen Formel B 5 H 9. Es ist eines der am häufigsten vorkommenden Borane , obwohl es sehr reaktiv ist. Es kommt in Form einer farblosen diamagnetischen Flüssigkeit mit einem stechenden Geruch vor. Wegen seiner sehr hohen Reaktivität mit Sauerstoff galt es in den 1950er Jahren in der UdSSR und den USA als vielversprechender Treibstoff in der Raumfahrt und wurde damals als "exotischer Treibstoff" bezeichnet. Aufgrund der charakteristischen grünen Farbe der Flamme, die bei der Verbrennung von Borverbindungen entsteht, wurde Pentaboran in der amerikanischen Industrie als „ Grüner Drache “ bezeichnet.
Struktur, Synthese und Eigenschaften
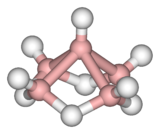
Das Molekül , Pentaboran besteht aus fünf Atome von Bor in einer pyramidalen Anordnung mit quadratischer Grundfläche angeordnet sind . Jedes Boratom gebunden ist an eine terminalen Hydrid - Liganden , während vier verbrückende Hydridliganden an der Basis Boratome gebunden sind. Das Ganze wird als Nido- Käfig bezeichnet , daher der IUPAC- Name von Nido- Pentaboran (9).
Pentaboran wurde erstmals durch Pyrolyse von Diboran B 2 H 4 . hergestelltbis etwa 200 °C . Ein besserer Syntheseweg geht vom Anion aus [B 3 H 8] - , umgewandelt in Bromid [B 3 H 7 Br] - durch Wasserstoff Bromid HBr, einen Bromid , dessen Pyrolyse gibt Pentaboran:
5 [B 3 H 7 Br] - → 3 B 5 H 9+ 5 Br - + 4 H 2.Pentaboran zersetzt sich oberhalb von 150 °C unter Freisetzung von Wasserstoff H 2, die in einem geschlossenen Gehäuse gefährliche Überdrücke verursachen können. Es ist in Gegenwart von Wasser viel stabiler als Diboran. Es ist löslich in Kohlenwasserstoffen wie Benzol C 6 H 6und Cyclohexan C 6 H 12, sowie in Fetten, einschließlich solcher, die in Laborgeräten verwendet werden. Seine Zersetzung während der Lagerung bleibt begrenzt, wobei Wasserstoff mit einem festen Rückstand freigesetzt wird.
Reaktionen
Die Chemie von Pentaboran ist vielfältig. Die Halogenierung ergibt ein symmetrisches Derivat B 5 H 8 X, mit dem Halogen an der Spitze der Pyramide, das isomerisiert werden kann, um das Halogen an einem der Boratome in der quadratischen Basis der Pyramide zu platzieren.
Mit dem Fundament stark, wie Organolithium , kann es sein , deprotoniert , und Salze von Lithium resultierenden reagieren mit verschiedenen Elektrophilen zu substituierten Derivaten.
Es ist eine Lewis - Säure , die bildet Doppel Addukte mit zwei Äquivalenten Trimethylphosphin P (CH 3 ) 3.
Pentaboran wird verwendet, um andere Borane zu synthetisieren .
Risiken
Pentaboran die Dämpfe sind schwerer als Luft und können ab 30 °C explosionsfähige Konzentrationen bilden . Es ist eine pyrophore Verbindung , das heißt, sie entzündet sich bei Kontakt mit Luft spontan. Es bildet leicht explosive Verbindungen, die stoßempfindlich sind, und reagiert heftig mit bestimmten Substanzen, die zur Brandbekämpfung verwendet werden, insbesondere mit Wasser und Halogenalkanen (und halogenierten Kohlenwasserstoffen im Allgemeinen). Es ist sehr giftig, und die Symptome einer leichten Vergiftung können bis zu 48 Stunden nach der Exposition auftreten. Seine akute Toxizität ist mit der von bestimmten Innervationsmitteln vergleichbar .
Der Expositionsgrenzwert der Vereinigten Staaten von OSHA und NIOSH beträgt 0,005 ppm ( 0,01 mg · m -3 ) über einen Zeitraum von acht Stunden, mit einem kurzfristigen Expositionsgrenzwert von 0,015 ppm ( 0,03 mg · m -3 ). Die akute Toxizität von Pentaboran macht es ab 1 ppm sofort gesundheits- und lebensgefährlich .
Hinweise und Referenzen
- PENTABORAN , Sicherheitsdatenblatt (e) des International Program on Chemical Safety , eingesehen am 9. Mai 2009
- (in) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC, 16. Juni 2008, 89 th ed. , 2736 S. ( ISBN 978-1-4200-6679-1 und 1-4200-6679-X ) , p. 9-50
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- " Pentaborane " in der Datenbank für chemische Produkte Reptox des CSST (Quebec-Organisation für Arbeitssicherheit und Gesundheitsschutz), abgerufen am 23. April 2009
- (in) Alfred Stock, The Hydrides of Boron and Silicon , Cornell University Press, 1933, New York, ( ISBN 0-8014-0412-6 ) .
- (en) VR Miller GE Ryschkewitsch, D. Gaines, N. Keipe , " Pentaboran (9) (B 5 H 9 ) ” , Anorganische Synthesen , vol. fünfzehn,1974( DOI 10.1002 / 9780470132463.ch26 , online lesen )
- (in) Norman N. Greenwood, Alan Earnshaw (1997). Chemie der Elemente , 2 e Ausgabe, Butterworth Heinemann, 1997 ( ISBN 0-08-037941-9 ) .
- (in) " Pentaboran " auf The National Institute for Occupational Safety and Health (NIOSH) , 11. April 2016(Zugriff am 24. Juli 2017 ) .
- (in) " Pentaboran " auf The National Institute for Occupational Safety and Health (NIOSH) , 4. Dezember 2014(Zugriff am 24. Juli 2017 ) .
