Natriumjodat
| Natriumjodat | |||
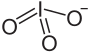 Struktur von Natriumiodat. |
|||
| Identifizierung | |||
|---|---|---|---|
| N o CAS | |||
| N o ECHA | 100,028,793 | ||
| N o EG | 231-672-5 | ||
| LÄCHELN |
[O-] I (= O) = O. [Na +] , |
||
| InChI |
Std. InChI: InChI = 1S / HIO3.Na / c2-1 (3) 4; / h (H, 2,3,4); / q; + 1 / p-1 Std. InChIKey: WTCBONOLBHEDIL-UHFFFAOYSA-M |
||
| Aussehen | weiße Kristalle | ||
| Chemische Eigenschaften | |||
| Brute Formel | Na I O 3 | ||
| Molmasse | 197,8924 ± 0,0009 g / mol I 64,13%, Na 11,62%, O 24,25%, |
||
| Physikalische Eigenschaften | |||
| T ° Fusion | 425 ° C. | ||
| Löslichkeit | 947 mg · l -1 | ||
| Volumenmasse | 4,28 g · cm & supmin ; ³ | ||
| Vorsichtsmaßnahmen | |||
| SGH | |||
   Achtung H272, H302, H334, P220, P261, P311, P342, H272 : Kann das Feuer verstärken ; Oxidationsmittel H302 : Schädlich beim Verschlucken H334 : Kann beim Einatmen Allergie oder Asthmasymptome oder Atembeschwerden verursachen. P220 : Von Kleidung fernhalten / lagern /… / brennbaren Materialien P261 : Staub / Dämpfe / Gase / Nebel / Dämpfe / Aerosole nicht einatmen . P311 : Rufen Sie ein GIFTZENTRUM oder einen Arzt an. P342 : Bei Auftreten von Atembeschwerden: |
|||
| Transport | |||
1479 : OXIDIZING SOLID, NOS Klassifizierungscode: 5.1 : Oxidierende Substanzen  |
|||
| Einheiten von SI und STP, sofern nicht anders angegeben. | |||
Das Natriumiodat ist eine chemische Verbindung der Formel NaIO 3. Es ist ein Salz der Jodsäure HIO 3. Es ist ein Oxidationsmittel und daher ein Oxidationsmittel, das für Brände verantwortlich ist, wenn es mit brennbaren Materialien oder Reduktionsmitteln in Kontakt kommt .
Vorbereitung
Natriumjodat kann durch Umsetzen von Jodsäure mit einer Natrium enthaltenden Base erhalten werden :
HIO 3+ NaOH → NaIO 3+ H 2 O..Es wird auch durch Hinzufügen der Diode I 2 erhaltenzu einer heißen und konzentrierten Lösung von Natriumhydroxid NaOH oder Natriumcarbonat Na 2 CO 3 ::
3 I 2+ 6 NaOH → NaIO 3+ 5 NaI + 3 H 2 O..Reaktionen
Natriumjodat kann zu Natriumperiodat NaIO 4 oxidiert werdenmit wässrigen Lösungen von Hypochlorit ClO - oder anderen starken Oxidationsmitteln:
NaIO 3+ NaOCl → NaIO 4+ NaCl .Anmerkungen und Referenzen
- berechnete Molekülmasse von „ Atomgewichte der Elemente 2007 “ auf www.chem.qmul.ac.uk .
- SIGMA ALDRICH